
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Лекция 5 Вторичные хит (аккумуляторы).
В аккумуляторах используются обратимые электрохимические системы, в которых запас израсходованных в процессе работы ХИТ активных веществ может быть восстановлен путем заряда – при пропускании через систему постоянного тока в направлении, противоположном току разряда.
Основными типами вторичных ХИТ являются свинцовые кислотныеищелочныеаккумуляторы.
Свинцовые кислотные аккумуляторы
Несмотря на более чем вековой срок
эксплуатации, свинцовые кислотные
аккумуляторы, в которых используется
электрохимическая система
![]() Pb|H2SO4|PbO2cE=
2,047B,Uср.р.= 1,92 В (E– ЭДС;Uср.р.– среднее напряжение разряда) все еще
очень распространены.
Pb|H2SO4|PbO2cE=
2,047B,Uср.р.= 1,92 В (E– ЭДС;Uср.р.– среднее напряжение разряда) все еще
очень распространены.
Мировое производство аккумуляторов этого типа превышает 100 млн.единиц в год, на него расходуется более половины мировой добычи свинца. Это объясняется относительной дешевизной аккумуляторов, стабильными разрядными характеристиками, возможностью эксплуатации в импульсных режимах, при которых Рудможет достигать 150 – 300 Вт/кг, работоспособностью в широком температурном интервале (от -50 до +50С), надежностью в работе. Типы пластин и некоторые характеристики свинцовых кислотных аккумуляторов различного назначения приведены в таблице 5.1.
Таблица 5.1
Типы свинцовых кислотных аккумуляторов различного назначения
|
Аккумулятор |
Пластины |
Удельная энергия |
Ресурс | ||
|
Вт∙ч/кг |
кВт∙ч/м3 |
Циклы заряд-разряд |
Годы | ||
|
Стартерный (автомобильный)
Тяговый
Стационарный |
и
(пастированные)
панцирные
поверхностные
пастированные |
26 – 28
20 – 28
8 – 12 |
60 – 70
55 – 75
-
|
100 – 300
800 – 1200
- |
2 – 4
4 – 6
10-12
|
При разряде аккумулятора расходуется серная кислота, и активные массы обоих электродов превращаются в сульфат свинца. В соответствии с современными представлениями, механизм токообразующих реакций описывается уравнениями:
Pb +
![]()
![]() PbSO4
+ H+
+ 2
PbSO4
+ H+
+ 2![]() ; (5.а)
; (5.а)
PbO2
+
![]() + 3H+
+ 2
+ 3H+
+ 2![]()
![]() PbSO4
+ H2O; (5.б)
PbSO4
+ H2O; (5.б)
 Pb + PbO2
+ 2H2SO4
Pb + PbO2
+ 2H2SO4
![]() =
2PbSO4
+ 2H2O; (5.в)
=
2PbSO4
+ 2H2O; (5.в)
По приближенной формуле ЭДС аккумулятора в зависимости от плотности раствора серной кислоты (г/см3) выражается следующей формулой:
Е= 0,85 +(В). (5.1)
Разрядно-зарядные кривые системы (рис. 5.1) имеют соответственно три и четыре характерных участка, ход которых, согласно уравнениям (3.4) и (3.5), может быть объяснен следующим образом. На участках I повышение напряжения заряда U3(снижениеUр(напряжения разряда)) связано с диффузионными затруднениями вследствие повышения (понижения) концентрации раствораH2SO4в порах электродов в первый момент после включения аккумулятора на заряд (разряд). На участках II вследствие создавшихся градиентов концентрации диффузия электролита в глубинные участки пористых электродов (или из них) выравнивает ход зарядной (разрядной) кривой, и ростUз(уменьшениеUР), происходит в соответствии с влиянием на ЭДС концентрации электролита. В ходе разряда пористость пластин уменьшается, чему способствует различие в физических свойствах активных веществ, принимающих участие в токообразующем процессе (табл. 5.2). Образующийся слабопроводящий плотный осадокPbSO4пассивирует электроды, и в конце разряда наIIIучастке происходит резкое падениеUрза счет омических и поляризационных затруднений. При нормальном (10-часовом) разряде конечное напряжение разрядаUркне должно быть меньше 1,7 В, при 5-часовом режиме разряда (пунктирная разрядная кривая на рис. 5.1) – 1,5 В.
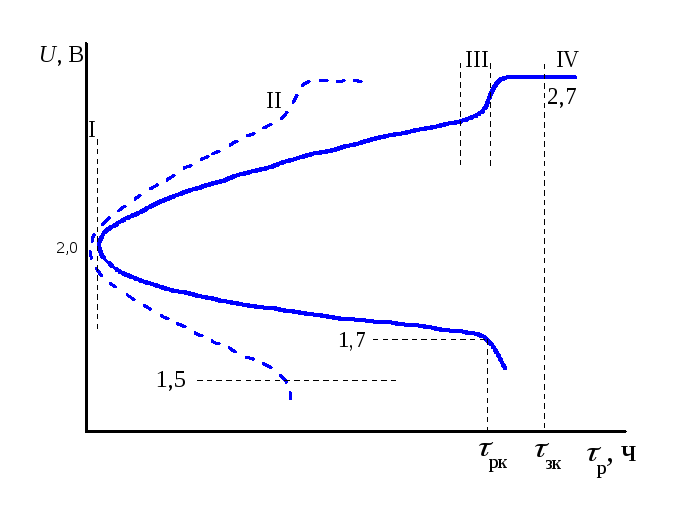
Рис. 5.1 Зарядно-разрядные кривые свинцового аккумулятора
Таблица 5.2
Физические свойства веществ, принимающих участие в токообразующей реакции
|
Вещество |
Плотность, г/см3 |
Объем 1 моль, мл |
Удельное сопротивление, Ом∙см |
|
Pb PbO2 PbSO4 H2SO4 |
11,4 9,4 6,3 1,24–1,32 |
18,27 26,84 28,65 - |
1,83∙10-4 2,8∙10-1 107 1,3 |
На участке IIIзарядной
кривой наблюдается резкий подъем
напряжения – до 2,6 – 2,7 В в связи с
одновременным увеличением как омической
(электрическая проводимостьH2SO4в этой области концентраций уменьшается),
так и поляризационной составляющей; к
этому времени заряд, в основном, закончен.
НаIVучастке зарядной
кривой плато при напряжении 2,7 В отвечает
процессу разложения воды с выделением
водорода на отрицательной пластине:
2H++2![]() →H2и выделением кислорода на положительной
пластине: 2Н2О→ 4Н++О2+ 4
→H2и выделением кислорода на положительной
пластине: 2Н2О→ 4Н++О2+ 4![]() .
Таким образом, признаками заряда
свинцовых кислотных аккумуляторов
являются повышение напряжения до 2,6 –
2,7 В; “кипение” электролита (обусловленное
выделением газообразных водорода и
кислорода) у обоих электродов и постоянство
концентрации (плотности), которую следует
определять примерно через 0,5 ч. после
отключения аккумулятора о зарядного
устройства.
.
Таким образом, признаками заряда
свинцовых кислотных аккумуляторов
являются повышение напряжения до 2,6 –
2,7 В; “кипение” электролита (обусловленное
выделением газообразных водорода и
кислорода) у обоих электродов и постоянство
концентрации (плотности), которую следует
определять примерно через 0,5 ч. после
отключения аккумулятора о зарядного
устройства.
Увеличению емкости свинцового аккумулятора способствуют факторы, улучшающие условия доставки (диффузии) электролита.
Пористость и структура активной массы.Чем тоньше и более пористы пластины, тем выше при данном разрядном токе коэффициенты использования активных масс и тем меньше срок их службы. Если при малыхIрКиав= 40 – 60%, то при высоких – всего 5 – 10% из-за концентрационной поляризации и пассивации электродов (экранированием их осадкомPbSO4).
Особенно подвержены сжатию (более чем на 20%) в процессе разряда отрицательные пластины, так как губчатый свинец обладает высокой свободной энергией. Поэтому при производстве свинцовых пластин используют расширители (обычно поверхностно-активные органические вещества – сажу, дубитель БНФ и др.) в количестве до 1%, а также BaSO4, кристаллическая структура которого изоморфна структуреPbSO4. Это способствует созданию большого числа зародышей кристаллизацииPbSO4при разряде и соответствующему разрыхлению отрицательной активной массы. Из кристаллов двойной солиPbBaSO4при заряде образуется губчатый свинец большой поверхности, улучшается работа пластин при низких температурах. Расширители также улучшают работу аккумулятора при форсированных режимах разряда, при использовании в холодное время года более концентрированного электролита.
Склонность положительных электродов к пассивации зависит от модификации PbO2. Так как α-PbO2иPbSO4изоморфны, то при разряде α-PbO2 образуется плотный слойPbSO4, иКиавпримерно в 1,5…3 раза меньше, чем при разряде β- PbO2, образующегося при циклировании аккумулятора. Таким образом, при проведении тренировочных циклов заряд – разряд на положительных пластинах увеличивается количество β- PbO2, из которого при разряде образуетсяPbSO4 комковатой формы, не препятствующей диффузии электролита вглубь пластин.
Ток заряда (разряда).Чем вышеIр, тем меньшую роль играет толщина пластин, так как глубинные слои активной массы не прирабатываются. Ход зарядных и разрядных кривых при повышенииIзиIрпоказан на рис.5.1 пунктирными кривыми.
Влияние температуры.Зная емкость при одной температуре (Qt1), можно определить емкость при другой температуре (Qt2), используя уравнение
![]() (5.2)
(5.2)
где α– коэффициент, зависящий от типа аккумулятора (α= 0,01 для стартерных и 0,007 для стационарных аккумуляторов).
Концентрация серной кислотыПлотность электролита подбирают в зависимости от температурных условий эксплуатации аккумулятора 1,24 г/см3в теплое и до 1,32 г/см3 в холодное время года. Повышение концентрацииH2SO4способствует образованию мелкокристаллического осадкаPbSO4при разряде, что препятствует приработке глубинных слоев активной массы. Поэтому при формировании пластин плотность раствораH2SO4 не превышает 1,1 г/см3.
При отдаче 1 А∙ч емкости происходит концентрация (уменьшение объема) электролита на 1 мл. Чтобы удержать больше кислоты у положительных пластин, на которых при разряде выделяется вода, разбавляющая H2SO4, межэлектродная сепарация (мипор, мипласт, поровинил, часто дублируемые сепарацией из стекловолокна в стартерных аккумуляторах) укладывается бороздками, создающими дополнительный объем электролита, к положительной пластине.
