
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Окислительно – восстановительные (redox) системы.
В отличие от электродов первого и второго рода, где металл и раствор обмениваются катионами, в окислительно–восстановительных электродах между этими фазами осуществляется только электронный обмен, а в качестве металлической фазы используется какой – то благородный металл (золото, платина), но чаще именно платина. Применим уравнение (7.1) к реакции (7.д).
![]() (7.д)
(7.д)
В итоге получаем:
![]()
![]() -это
стандартный окислительно–восстановительный
потенциалredoxреакций.
-это
стандартный окислительно–восстановительный
потенциалredoxреакций.
Для реакции
![]() (7.е)
(7.е)
получаем:
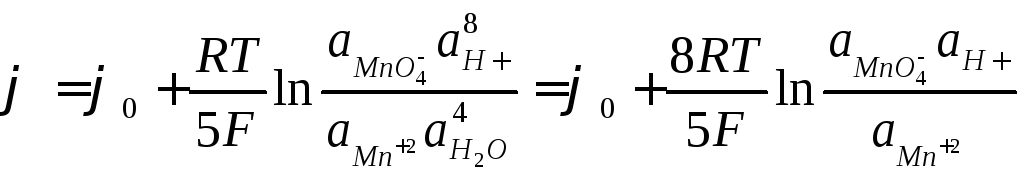 (7.7)
(7.7)
Таблица 7.2
Стандартные потенциалы некоторых окислительно-восстановительных – систем.
|
Электрод |
Реакция |
n |
|
|
PbSO4/PbO2 |
PbSO4+2H2O
|
2 |
+1.685 |
|
Mn+2/ |
Mn+2+4H2O
|
5 |
+1.51 |
|
HNO2/ |
HNO2+H2O
|
2 |
+0.92 |
|
Fe+2/Fe+3 |
Fe+2 |
1 |
+0.80 |
|
Cu+/Cu+2 |
Cu+ |
1 |
+0.153 |
|
H2/2H+ |
H2 |
2 |
0 |
|
Cr+2/Cr+3 |
Cr+2 |
1 |
-0.41 |
|
Fe(OH)2/Fe(OH)3 |
Fe(OH)2
+OH-
|
1 |
-0.56 |
Водородный электрод.
Водородный электрод является разновидностью окислительно-восстановительного электрода и представляет собой платиновую пластину, покрытую платиновой чернью, помещённую в раствор серной кислоты (рис. 7.2). К этой пластине осуществляется подача газообразного водорода при температуре 25C, и давлении водорода в 1 атмосферу. Молекулы водорода адсорбируются на платине, распадаясь при этом на атомы. На поверхности пластины устанавливается следующее равновесие:
2H++ 2![]()
![]() H2 (7.ж)
H2 (7.ж)
Потенциал этого электрода может быть выражен уравнением:
![]() (7.8)
(7.8)
1M
H2SO4
Рис. 7.2 Схема водородного электрода
Хингидронный электрод.
Рассмотрим реакцию:
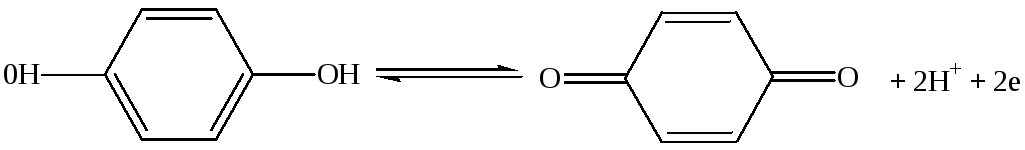
(7.з) Это окислительно-восстановительный процесс перехода гидрохинона в хинон.
![]() (7.и)
(7.и)
К реакциям (7.и) и (7.з) применим уравнение Нернста.
![]() (7.8)
(7.8)
Из (7.8) при
![]() мы получаем:
мы получаем:
![]() (7.9)
(7.9)
Т.е. используя хингидронный электрод и измеряя его потенциал, мы фактически определяем pH раствора.
Мембранный потенциал или потенциал Донана.
Если фазовая граница между двумя электролитами проницаема не для всех ионов, то на этой границе может установиться некая равновесная разность потенциалов. Её называют потенциалом Донана или мембранным потенциалом. Ионы, для которых эта граница непроницаема, сохраняются в каждом из электролитов в своей первоначальной концентрации. Такой потенциал наблюдается на клеточных мембранах. Существует он и в организме человека. Благодаря этому потенциалу существует обмен веществ и по существу протекает сама жизнь.
Наиболее широкое применение нашел стеклянный электрод. Впервые он был применён И.Кремером в 1906г. для измерения pH. Устройство стеклянного электрода показано на рисунке 7.3.

Рис. 7.3 Измерение pH с использованием стеклянного электрода. 1 – металлический проводник; 2 - солевой мостик, соединяющий ячейку с электродом сравнения; 3 –сосуд с исследуемым раствором. 4 – колба со стандартным раствором; 5 – мембрана с толщиной стенки 0,01 – 0,001 мм.
Запишем уравнение Нернста для такой системы:
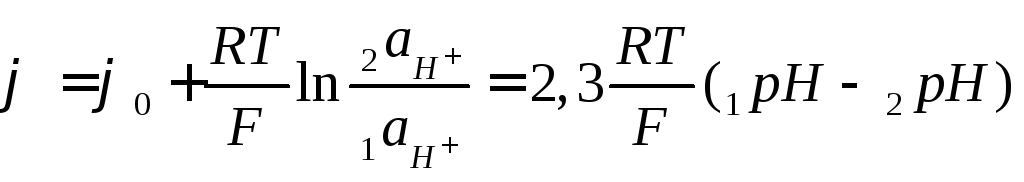 , (7.10)
, (7.10)
где индекс 1 соответствует внутреннему электролиту, а 2 - внешнему.
Очевидно, что такой электрод измеряет разность pH. Это наиболее распространённый метод измеренияpHрастворов.
Тончайшая мембрана может быть использована
для измерения концентрации в принципе
любого иона, если через неё протекает
или переносится только этот ион. Такие
электроды называются ион-селективными.
Существуют электроды для определения
концентрации
![]() ,Cl -,F-, Br –и многих других ионов. При определении
концентрации соответствующего иона с
помощью ион-селективных электродов
определяется разность равновесных
потенциалов между этим электродом и
электродом сравнения.
,Cl -,F-, Br –и многих других ионов. При определении
концентрации соответствующего иона с
помощью ион-селективных электродов
определяется разность равновесных
потенциалов между этим электродом и
электродом сравнения.
Приборы для их измерения называются pH–метрами или иономерами. Они состоят из стеклянного (для измеренияpH) или ион–селективного электрода (для измерения концентрации какого–либо иона) и измерительного прибора, в качестве которого используется вольтметр с очень высоким входным сопротивлением. Это необходимо для того, чтобы протекающий через систему ток был пренебрежимо малой величины, поскольку система должна находиться в состоянии равновесия. Использование этой системы для расчётов или измерений возможно только в том случае, если выполняется условие химического равновесия.
Вопросы и задачи
Определить равновесный потенциал системы Cr+3/Crотносительно насыщенного хлорсеребряного электрода при концентрацииCr+3в растворе 10-2моль/л.
Определить равновесный потенциал медного электрода (Cu/Cu+2) с концентрациейCu+20,1 моль /л относительно равновесного потенциала системыFe+2/Feс концентрациейFe+20,01 моль /л.
Каково будет напряжение ячейки, включающей электрод Cu+2/Cuпри концентрацииCu+21 моль /л иFe+3/Feс концентрацией 0,1 моль /лFe+3, если ток, протекающий в системе бесконечно мал?
Определить окислительно-восстановительный потенциал относительно насыщенного хлорсеребряного электрода системы
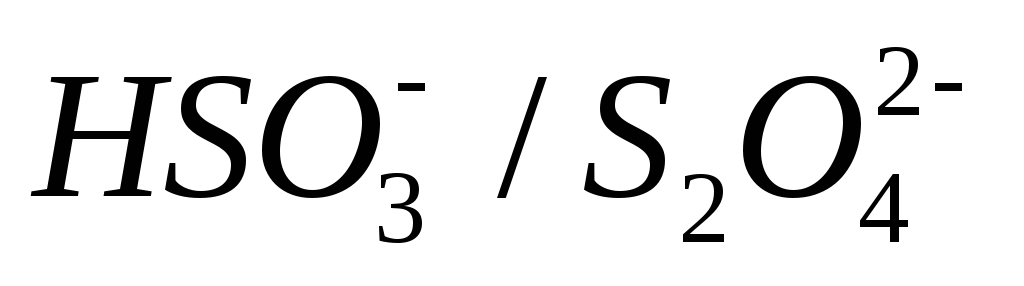 при их равных концентрациях в растворе
ирН= 3.
при их равных концентрациях в растворе
ирН= 3.Определить напряжение ячейки, состоящей из насыщенного каломельного электрода и платинового электрода, находящегося в равновесии с системой Co3+/Co2+при эквивалентных концентрациях окисленной и восстановленной форм.
Определить напряжение ячейки, состоящей из насыщенного хлорсеребрянного электрода и кадмиевого электрода, находящегося в растворе его соли с концентрацией 0,1 моль /л.
Лекция 8. Двойной электрический слой и явления адсорбции на границе электрод-раствор.
Адсорбционные явления и методы изучения двойного электрического слоя. Потенциал нулевого заряда. Механизм возникновения ЭДС электрохимической цепи. Строение двойного электрического слоя.
Переход электрона из метала на частицу, находящуюся в растворе, или обратный процесс, перенос электрона с частицы на электрод (т.е. основной электрохимический процесс) протекает на границе раздела фаз и зависит от того, как устроена эта граница. Поэтому знание строения границы между электродом и раствором имеет очень большое значение в электрохимии. Вся “драма”, называемая электродным процессом, разыгрывается на этой границе.
Необходимо учитывать два основных явления, связанных с образованием границы раздела электрод-раствор.
1. Энергетическая особенность границы заключается в том, что равновесная концентрация на границе и в объёме раствора не равны друг другу. Это явление получило название адсорбция. Принципиально заметить, что это весьма распространённое явление характерно не только для электрохимических процессов. Существует много примеров и в других химических процессах. Это целый раздел науки. Кроме того, существуют технологии получения и использования адсорбентов. Классическими примерами адсорбентов являются: активированный уголь, силикагель, адсорбенты для хроматографии и другие. В настоящее время целая отрасль промышленности работает в этом направлении. Наиболее распространённое и известное их применение - противогаз. Автором одного из первых противогазов был академик Н.Н.Зелинский, родившийся в Тирасполе. Впервые противогаз был применён в Первой мировой войне.
Причина адсорбции заключается в том, что на границе раздела фаз всегда имеются свободные валентные связи. Поэтому, чем больше граница, тем выше адсорбция. Это в одинаковой степени касается и заряженных частиц и электронейтральных поверхностей.
2. Вторая причина чисто электрохимическая. Она связана с тем, что поверхность заряжена. Вследствие этого, происходит электростатическое взаимодействие, которое может вызывать как электростатическое притяжение, так и отталкивание, т.е. адсорбция может быть положительной и отрицательной.

Рис. 8.1. Положительная и отрицательная адсорбция на границе раздела.
Поскольку в растворе находятся заряженные частицы, в объёме раствора за пределами слоя X1(рис. 8.1), выполняется условие электронейтральности. Внутри же этого слоя приX<X1условие электронейтральности уже не выполняется. Этот слой носит название двойного электрического слоя. Он существует на всех заряженных поверхностях: в аэрозолях, в любых дисперсных системах (растворах, газах и т.д.), в том числе и на электродах в электрохимических системах.
