
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
В концентрированных растворах электролитов необходимо учитывать взаимодействие ионов друг с другом. Именно это приводит к тому, что как бы снижается их концентрация. П.Дебаю и независимо от него Х.Гюккелю в 1923г. удалось на основе учета ион - ионного взаимодействия рассчитать средний коэффициент активности
![]() , (4.16)
, (4.16)
где
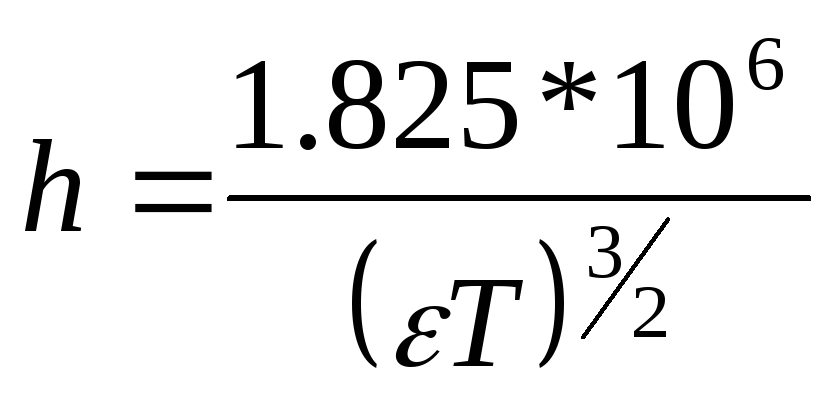 (4.17)
(4.17)
Уравнение (4.16) верно для 1 - 1 валентного электролита. Для более сложных случаев была получена эмпирическая формула Я.Бренстеда:
![]() (4.18)
(4.18)
В некоторых случаях можно использовать формулу Х.Гютельберга
![]() (4.19)
(4.19)
Теория Дебая – Гюккеля, таким образом, описывает ион – ионное взаимодействие в сильных электролитах и часто носит название теории сильных электролитов. Как видно из соотношений (4.16) – (4.19) теория Дебая – Гюккеля позволила рассчитать для некоторых частных случаев коэффициент активности, который объяснял ион – ионное взаимодействие, снижающее эффективную концентрацию частиц в растворах, учитывая и диэлектрическую проницаемость растворителя () и общую ионную силу раствора (I).
Вопросы и задачи
Пример 1.
Образование йодистого водорода протекает по реакции
H2+J2= 2HJ
Исходная концентрация водорода равна 1 моль/л, а йода – 0,6 моль/л. Рассчитать концентрации всех трех веществ в момент равновесия, если при некоторой температуре в реакцию вступило 50% водорода. Чему равна константа равновесия?
РЕШЕНИЕ. Из уравнения реакции видно, что вследствие взаимодействия одного моляН2с одним молем J2образуется 2 моляHJ. По условию задачи, в реакцию вступило 50% исходной концентрацииН2, т.е. 0,5 моль/лН2и столько же молейJ2, при этом образовался 1 мольНJ.
Следовательно, в момент равновесия, концентрации веществ были равны:
[H2]=1 моль/л – 0,5 моль/л = 0,5 моль/л
[J2]= 0,6 моль/л – 0,5 моль/л = 0,1 моль/л
[HJ]= 1 моль/л
Константу равновесия рассчитывает по уравнению, являющемуся следствием закона действующих масс:
К=![]() = 1/0,5·0,1 = 20
= 1/0,5·0,1 = 20
Пример 2.
Кажущаяся степень диссоциации раствора, содержащего 2,925 г NaClв 50 г воды, равна 0,80. Найти температуру замерзания раствора.
РЕШЕНИЕ. Находим изотонический коэффициентiсоли, приходящееся на 1000 г воды, из пропорции: 2,925:50 =х:1000;х= 58,5. Это – вес одной грамм-молекулыNaCl. По определению, ΔT=КС (1), где ΔT– понижение температуры замерзания раствора,С– концентрация (моляльная) растворенного вещества в молях на 1000 г растворителя. Из уравнения (1) видно, что когдаС= 1, ΔT=К, т.е. К есть коэффициент пропорциональности для данного растворителя. Для воды он равен 1,86оС. КоэффициентКв уравнении (1) называют криоскопической постоянной.
Фактически ΔTзависит от коэффициентаi, который можно найти из уравнения (4.4) 0,80 =i- 1/ 2-1;i= 1,8, отсюда ΔT=iКСи ΔT= 1,86·1,8 = 3,37о. Значит температура замерзания раствораNaCl= -3,37оС.
В обратимой реакции А + B = С + D исходные концентрацииАиBравны 1 моль/л, а константа равновесияК= 5. Вычислить равновесные концентрацииАиB.
Вычислить константу химического равновесия для обратимой реакции А + B=2С, если равновесная концентрация равна [А] = [B] = 0,1 моль/л, [С] = 0,4 моль/л.
Равновесие реакции 2NO+О2= 2NO2установилось при следующих концентрациях веществ: [NO] = 1,12 моль/л, [О2] = 0,56 моль/л, [NO2] = 0,88 моль/л. Рассчитать константу равновесия и исходные концентрации окиси азота и кислорода.
Раствор 1,7 г ZnCl2в 250 г воды замерзает при температуре – 0,24оС. Вычислить степень диссоциации соли.
Определить уксусная кислота сильный или слабый электролит, если раствор, содержащий 0,57 г кислоты в 100 г воды, замерзает при температуре – 0,181оС.
Температура замерзания раствора 2,93 г NaClв 50 г воды – 3,35оС. Определить степень диссоциации.
Лекция 5 Ионные равновесия в водных растворах
Ионные равновесия в водных растворах. Количественное определение кислотности водных растворов. Понятие pH и pK. Гидролиз солей. Буферные растворы. Произведение растворимости.
Благодаря теории электролитической диссоциации удалось определить, что такое кислота и что такое основание, а также количественно рассчитать степень кислотности растворов.
Из теории электролитической диссоциации следует, что кислота- это химическое соединение, которое в водном растворе диссоциирует с образованием ионов гидроксония (H3O+- гидратированных ионов водорода, которые в дальнейшем будут обозначаться простоH+) (5.а).Основание это соединение, диссоциирующее в водном растворе с образованием гидроксил - ионов (5.б).
HClO3
+ H2O
![]() H3O+
+
H3O+
+
![]() (5.a)
(5.a)
KOH
![]() K+
+ OH- (5.б)
K+
+ OH- (5.б)
Отсюда следует, что в зависимости от того, что преобладает в растворе ионы гидроксония или ионы гидроксила раствор будет кислотой или щелочью соответственно.
Я.Бренстед в 1923 году осуществил обобщение теории С.Аренниуса. По его определению кислота - это донор протонов, а основание - акцептор. Например, в реакции (5.а) HClO3– кислота, аH2O – основание. Более того, можно записать:
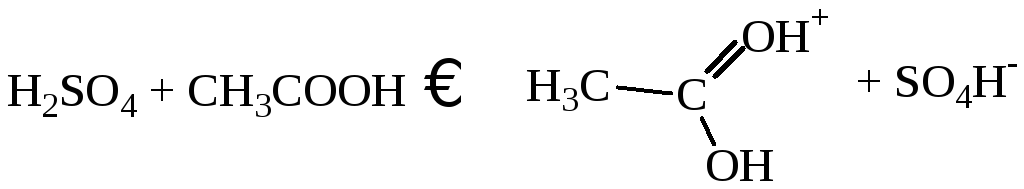 (5.в)
(5.в)
Из реакции (5.в) очевидна относительность понятия кислоты и основания. В реакции (5.в)CH3 COOH является основанием, а при взаимодействии с водойCH3COOH будет кислотой.
CH3
COOH + H2O
![]() H3O+
+ CH3
COOH- (5.г)
H3O+
+ CH3
COOH- (5.г)
Из вышеизложенного видно, что необходима количественная характеристика силы кислоты и основания. Для получения этих характеристик рассмотрим для примера только водные растворы.
Запишем реакцию диссоциации воды:
H2O
![]() H++OH-(5.д)
H++OH-(5.д)
Применяя к этому уравнению закон действующих масс, можно записать:
Kd
=
![]() (5.1)
(5.1)
Известно, что при 25CKd
= 3,2410-18,![]() = 1000/18 = 55,5 моль/л (концентрация “воды в
воде”). Тогда:
= 1000/18 = 55,5 моль/л (концентрация “воды в
воде”). Тогда:
![]() =Kd
=Kd![]() =Kив=
3.2410-1855,5
моль/л10-14моль/л
=Kив=
3.2410-1855,5
моль/л10-14моль/л
Константа Kивносит название ионное произведение воды.
Считая, что![]() получаем:
получаем:
![]() = 10-7моль/л (5.2)
= 10-7моль/л (5.2)
В 1920 г. Я. Соренсен ввёл понятие pH
pH = -lg [H+].(5.3)
Учитывая уравнения (5.2) и (5.3), получаем при равенстве концентраций ионов водорода и гидроксила, что pH= 7.
Аналогично pHможно ввести понятиеpOH:
pOH= -lg[OH-],(5.4)
Тогда очевидно, что:
pH + pOH = 14 (5.5)
Для кислой среды pH< 7, для щелочнойpH> 7, а в нейтральной средеpH= 7.
Для диссоциации кислоты можно записать аналогичное соотношение. Запишем его в общем виде:
AH
![]() A-
+H+ (5.ж)
A-
+H+ (5.ж)
Для данного уравнения запишем закон действующих масс:
Ka
= , (5.з)
, (5.з)
где Ка – константа диссоциации кислоты.
Введем понятие pKа - отрицательного логарифма константы ионизации кислоты:
pKа = - lgKa(5.6)
Если константа ионизации кислоты стремится к бесконечности, то есть кислота полностью диссоциирует, тоpK - . Для сильных кислотpKа отрицательно и чем больше его отрицательное значение, тем выше сила кислоты.
таблица 5.1
Значения pKанекоторых кислот
|
Кислота |
Константа диссоциации |
pKa |
|
HClO4(хлорная) |
Ka108 |
pKa= - 8 |
|
HCl (соляная) |
Ka 103 |
pKa =- 3 |
|
HNO3 (азотная) |
Ka 102 |
pKa =-2 |
|
HNO2 (азотистая) |
Ka 410-4 |
pKa = 3,4 |
|
HCN(синильная) |
Ka410-10 |
pKa9,4 |
Рассмотрим поведение слабых кислот
![]() в
растворе.У
в
растворе.Учитываязакон разведения В. Оствальда применительно
к слабой кислоте (4.11) и (4.12), можно записать,
что:
[H+] =Ca (5.7)
![]() (5.8)
(5.8)
Из (5.8) следует, что кислотность слабых кислот связана с константами их диссоциации. Учитывая уравнение (5.3), можно записать, что для слабой кислоты:
pH= 0,5pKа– 0,5lgCa,(5.9)
аналогично для слабого основания с учетом (5.5):
pH= 14 – 0,5pKb+ 0,5lgCb,(5.10)
Kа,Kb, Ca,Cb – константы диссоциации и концентрации кислот и оснований соответственно.
Значения Ka иKb приводятся в справочниках. По уравнениям (5.9) и (5.10) можно рассчитыватьpH слабых кислот и оснований. Для сильных кислот и оснований необходимо использовать уравнения (5.3) - (5.5).
