- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Электрохимическая размерная обработка металлов и сплавов
Область транспассивности (область 5 на рис. 15.7) также широко используется в практике. В этой области происходит высокоскоростное анодное растворение металлов и сплавов. Растворение с высокой скоростью широко используется в практике электрохимической размерной обработки металлов (ЭХРО). Для этого используется катод-инструмент определённой формы, изготовленный из меди или нержавеющей стали.
Устанавливается малый межэлектродный зазор (МЭЗ) между катодом-инструментом и заготовкой, катод-инструмент подводится к поверхности и через зазор с высокой скоростью прокачивается электролит. При этом происходит копирование формы электрода – инструмента (катода) на заготовке, являющейся анодом.
Чем выше плотность тока (скорость растворения), тем будет выше скорость обработки и точность копирования электрода-инструмента. Анодное растворение металла при этом происходит в области транспассивного растворения. Наличие пассивности в области низких плотностей тока и высокой скорости растворения в области транспассивности, обеспечивают высокую точность ЭХРО. Так, например, резкий переход из пассивности в область транспассивности для железа и стали в растворах NaClO3обеспечивает высокую точность копирования при ЭХРО в таких электролитах. ЭХРО широко применяется в тех случаях когда:
необходимо обрабатывать материалы, обработка которых затруднена на обычных металлорежущих станках;
нужно осуществлять обработку деталей сложной формы. В этом случае посредствам копирования формы катода-инструмента на заготовке удается уменьшить количество операций, необходимых при механической обработке;
имеет место совокупность вышеперечисленных условий.
Вопросы и упражнения
Найдите графически скорость коррозии (в мг/с·см2) и величину потенциала коррозии железа при водородной деполяризации, если плотность тока обмена для реакции
Fe→Fe+2+ 2![]()
равна 10-9 А/см2, наклоны анодной и катодной тафелевских кривых равны 100 мВ/порядок, а при коррозии железа образуется его соль с концентрацией 10-1моль/л.
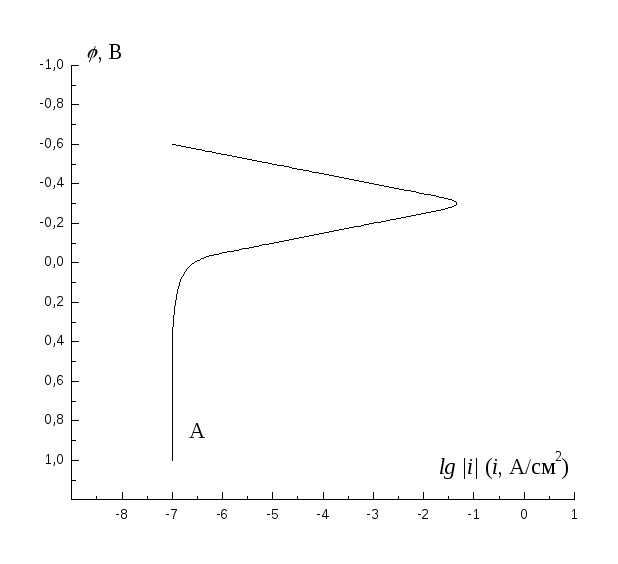
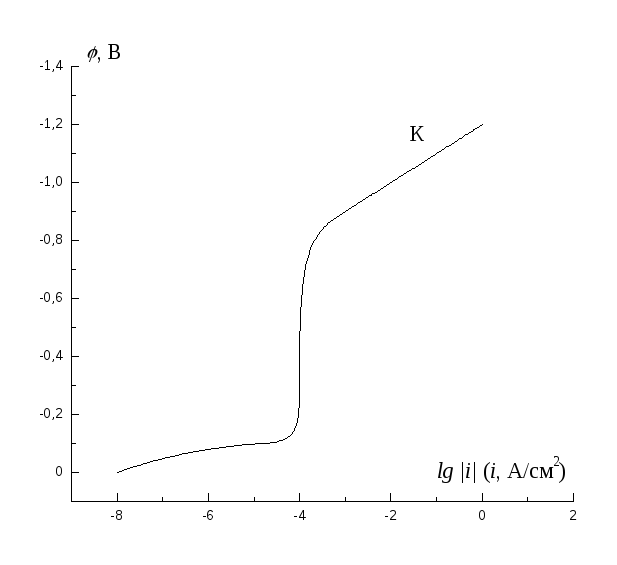
Определите потенциал и скорость коррозии металла при кислородной деполяризации, если катодная кривая восстановления растворенного кислорода определяется кривой Кна рисунке, величина равновесного потенциала металла равна – 0,35 В, плотность тока обмена для этой реакции 10-7А/см2, а тафелевский наклон кривой анодного растворения металла равен 50 мВ/порядок.
Анодная поляризационная кривая имеет вид, изображенный на рискнке. Определите скорость коррозии этого металла при водородной деполяризации, если плотность тока обмена выделения водорода на этом металле равна 10-8А/см2, а тафелевский наклон кривой выделения водорода 100 мВ/порядок.
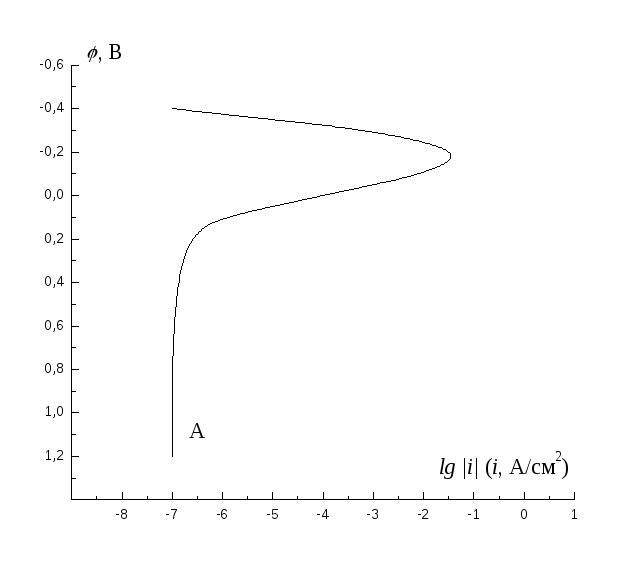
Определите графически потенциал и скорость коррозии металла, имеющего равновесный потенциал –0,6 В, величину тока обмена 10-6А/см2при тафелевском наклоне 100 мВ/порядок, если плотность предельного диффузионного тока катодного восстановления кислорода равна 10-3А/см2, а коррозия происходит при кислородной деполяризации.
Определите потенциал и скорость коррозии, анодная поляризационная кривая для которой имеет вид Ана рисунке, если сопряженная анодному растворению реакция восстановления окислителя имеет равновесный потенциал +0,4 В, плотность тока обмена для этой реакции равна 10-9А/см2, а тафелевский наклон 50 мВ/порядок.