
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Ионные равновесия при растворении. Произведение растворимости.
Ниже на основе теории электролитической диссоциации будет осуществлена количественная трактовка процессов растворения различных соединений. Запишем уравнение электролитичекой диссоциации малорастворимого соединения, например сульфата бария:
BaSO4(тв.)
![]()
![]() +
+![]() (5.k)
(5.k)
Тогда 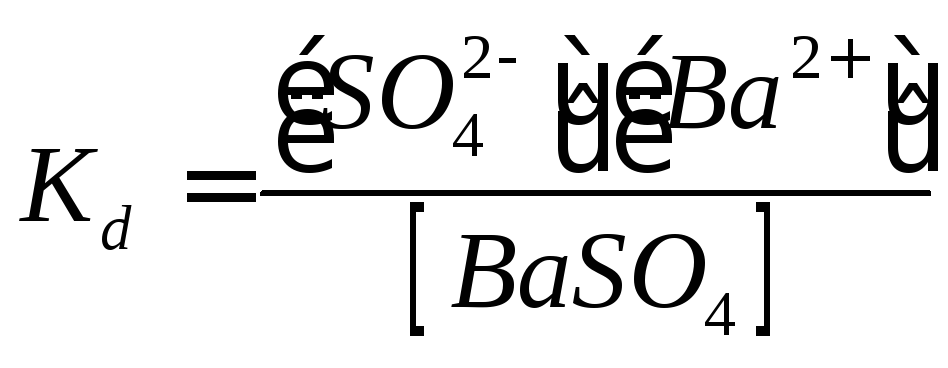 .
Учитывая, что величина [BaSO4]
практически постоянна, можно записать
[BaSO4]Kd=
.
Учитывая, что величина [BaSO4]
практически постоянна, можно записать
[BaSO4]Kd=![]() =ПР, т.е. произведение
=ПР, т.е. произведение![]() постоянно. Чем оно меньше, тем меньше
растворимость соответствующего
соединения.
постоянно. Чем оно меньше, тем меньше
растворимость соответствующего
соединения.
Эта константа носит название произведения растворимости (ПР)
ПР=![]() (5.18)
(5.18)
В общем случае можно записать, что для реакции:
![]() (5.л)
(5.л)
величина произведения растворимости может быть выражена соотношением:
![]() (5.19)
(5.19)
Если произведение
![]() ,
то вещество будет находиться в растворе.
Если же
,
то вещество будет находиться в растворе.
Если же![]() ,
то вещество будет выпадать в осадок до
тех пор, пока не будет установлено
равновесие (достигнуто произведение
растворимости). Чем ниже произведение
растворимости, тем труднее растворимо
вещество.
,
то вещество будет выпадать в осадок до
тех пор, пока не будет установлено
равновесие (достигнуто произведение
растворимости). Чем ниже произведение
растворимости, тем труднее растворимо
вещество.
Значения произведения растворимости находятся в справочных таблицах.
Таблица. 5.2
Значения произведения растворимости для некоторых труднорастворимых соединений
|
Уравнение диссоциации |
ПР |
|
BaSO4 |
110-10 |
|
Ag2CrO4 |
210-12 |
|
Ag2CO3 |
810-12 |
|
Al(OH)3 |
110-34 |
|
Cd(OH)2 |
310-14 |
Из значения произведения растворимости
легко вычислить растворимость (S)соответствующего соединения![]() .
.
![]() (5.20)
(5.20)
Запишем для Ag2CrO4произведение растворимости![]() ,
тогда
,
тогда![]() .
Откуда получаем уравнение для растворимости
Ag2CrO4:
.
Откуда получаем уравнение для растворимости
Ag2CrO4:
![]() (5.21)
(5.21)
Аналогичным образом можно рассчитать произведение растворимости для Al(OH)3
![]()
ПР=S(3S)3= 27S4
![]() (5.22)
(5.22)
Таким образом можно из значения произведения растворимости рассчитать растворимость любого соединения.
Вопросы и задачи
pHраствора сильной кислоты равно 4,4. Определить концентрацию ионов водорода.
Вычислить pH0,01М раствора гидроксида серебра.
Вычислить pH0,01М раствора азотной кислоты.
Определить pH0,1М раствора натриевой соли синильной кислоты.
Вычислить pH0,1М раствора метаборнокислого натрия (формула метаборной кислотыHBO2).
Вычислить pH0,1М раствора синильной кислоты.
Вычислить концентрацию ионов водорода и гидроксила раствора сильной кислоты, если его pHравно 0,3.
Вычислить концентрацию ионов водорода и гидроксила в 110-3М раствореKOH.
Электроосаждение цинка проходит из водного раствора сульфата цинка при pH= 10. Что необходимо добавлять в раствор этой соли, чтобы достичь требуемого значенияpH?
При электрохимической обработке меди скорость обработки ограничивается растворимостью образующейся при этом соли. Раствор какой соли целесообразно использовать, чтобы достичь максимальной скорости обработки?
Пользуясь табличными данными определить, какая соль в большей степени растворима в воде: AgClилиAg2CrO4?
Растворимость гидроксида цинка составляет 2,210-5г в 100 г воды. Вычислить
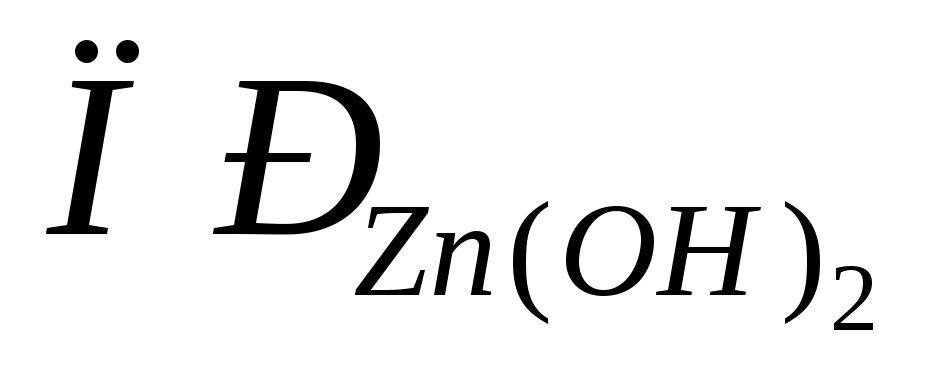 .
.Произведение растворимости гидроксида кальция
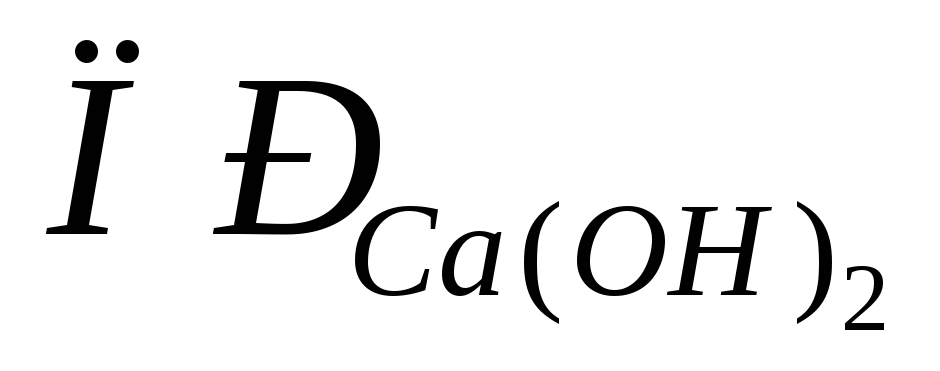 =
5,510-6. ВычислитьpH раствора,
содержащего 0,01 моль/лCa(OH)2.
=
5,510-6. ВычислитьpH раствора,
содержащего 0,01 моль/лCa(OH)2.Рассчитать растворимость карбоната серебра (
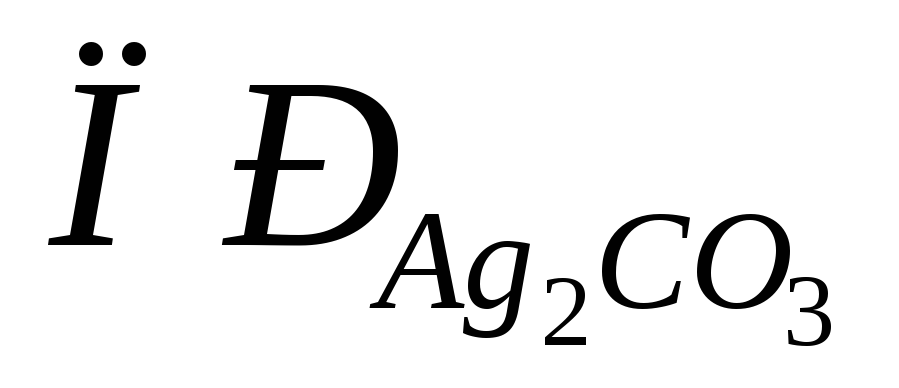 =
8,210-12).
=
8,210-12).
