
Химия Соснина
.pdf
растворе. Концентрации веществ, находящихся в твердой фазе, представляют собой
постоянную величину и входят в константу скорости реакции (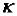 ). Например, для реакции горения угля:
). Например, для реакции горения угля:
С(Т) + О2(Г) = СО2(Г), кинетическое уравнение имеет вид:
(38)
где 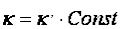 .
.
3.2.3. Зависимость скорости реакции от природы реагирующих веществ и температуры
Химическая реакция (разрыв связей между атомами в молекулах исходных веществ и образование новых связей между атомами в молекулах продуктов реакции, (см. рис. 32, подразд. 3.1) протекает при непосредственном столкновении молекул исходных веществ, причем последние должны обладать при этом достаточным запасом кинетической энергии, иначе их столкновение будет неэффективным.
Избыточная кинетическая энергия, которой должны обладать молекулы исходных веществ для того, чтобы их столкновение могло привести к образованию нового
вещества, называется энергией активацииданного процесса 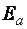 , кДж/моль. Молекулы,
, кДж/моль. Молекулы,
обладающие такой энергией, называются активными.
Энергия активации – это фактор, посредством которого природа реагирующих
веществ влияет на скорость реакции. Значения 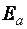 для химических реакций лежат в пределах 40….400 кДж/моль. Установлено, если:
для химических реакций лежат в пределах 40….400 кДж/моль. Установлено, если:
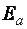 < 40 кДж/моль, скорость очень велика, реакции протекают практически мгновенно (ионные реакции в растворах);
< 40 кДж/моль, скорость очень велика, реакции протекают практически мгновенно (ионные реакции в растворах);
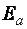 > 120 кДж/моль, скорость очень мала, реакции при обычных условиях визуально не видны (синтез аммиака);
> 120 кДж/моль, скорость очень мала, реакции при обычных условиях визуально не видны (синтез аммиака);
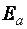 ≈ 40….120 кДж/моль, скорость характерна для большинства химических реакций, её можно замерить.
≈ 40….120 кДж/моль, скорость характерна для большинства химических реакций, её можно замерить.
В химических реакциях выделяется три последовательно сменяющихся энергетических состояния, примером может служить схема реакции синтеза иодистого водорода HJ:
Активированный комплекс возникает в качестве промежуточного состояния в ходе как прямой, так и обратной реакции. В состоянии активированного комплекса старые связи еще не разрушены, но уже ослаблены, новые связи наметились, но еще не образовались. Время существования его не велико (10–14….10–11 с). Энергетически он отличается от исходных веществ и продуктов реакции (рис. 35).
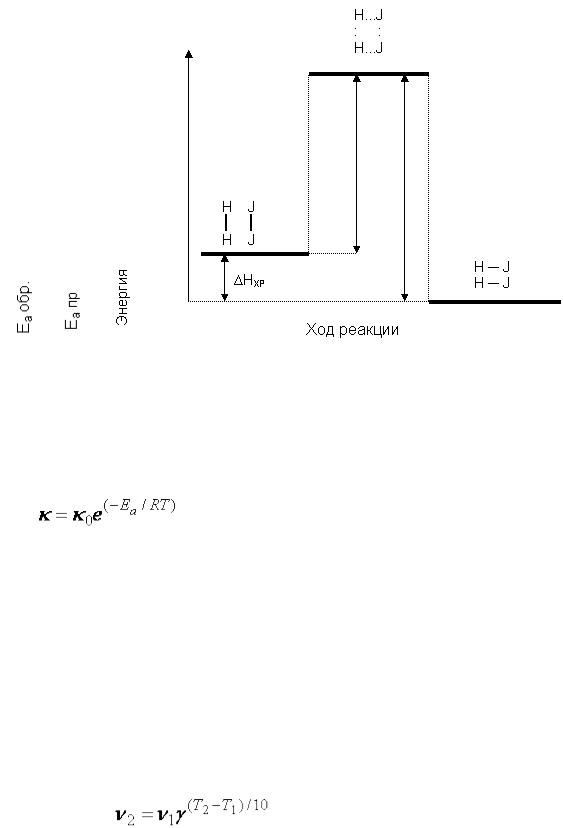
Рис. 35. Энергетическая схема реакции cинтеза HJ
Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации прямого или обратного процессов, при
этом 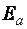 прямой реакции ≠ Еа обратной реакции.
прямой реакции ≠ Еа обратной реакции.
В 1889 г. шведский ученый С. Аррениус вывел уравнение, которое носит его имя:
, |
(39) |
где 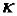 – константа скорости реакции;
– константа скорости реакции;  – предэкспоненциальный множитель (отражает частоту столкновений и ориентацию реагирующих частиц);
– предэкспоненциальный множитель (отражает частоту столкновений и ориентацию реагирующих частиц); 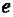 – основание натурального
– основание натурального
логарифма; 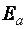 – энергия активации процесса;
– энергия активации процесса; 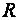 – универсальная газовая постоянная
– универсальная газовая постоянная
(8,314 Дж/моль∙К); 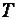 – абсолютная температура процесса, К.
– абсолютная температура процесса, К.
Из уравнения Аррениуса следует, что константа скорости реакции, а, следовательно, и скорость реакции, уменьшается с ростом энергии активации. Повышение же температуры процесса приводит к увеличению константы и скорости реакции.
Зависимость скорости реакции (константы скорости) от температуры определяется правилом Я. Вант-Гоффа (Голландия, 1884 г.).
При повышении температуры на 10 градусов скорость большинства реакций увеличивается в 2–4 раза:
, |
(40) |
где 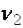 и
и  – скорости реакций при температурах
– скорости реакций при температурах  и
и 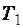 ;
; 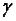 – температурный коэффициент скорости реакции.
– температурный коэффициент скорости реакции.
 – это число, показывающее, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов.
– это число, показывающее, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов.

С увеличением температуры растет число молекул, кинетическая энергия которых
равна или выше энергии активации 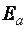 , следовательно, растет доля молекул, способных к активным столкновениям с образованием активированного комплекса, т. е. происходит ускорение реакции.
, следовательно, растет доля молекул, способных к активным столкновениям с образованием активированного комплекса, т. е. происходит ускорение реакции.
3.2.4. Механизмы химических реакций
Под механизмом химических реакций понимается последовательность протекания простейших стадий реакции. Классификация химических реакций по механизмам протекания представлена на рис. 36.
Рис. 36. Классификация химических реакций по механизму протекания
Число молекул реагентов, принимающих участие в элементарной стадии реакции,
называется молекулярностью реакции. Одностадийные реакции с молекулярностью более трех неизвестны.
Простые (одностадийные) реакции протекают через образование активированного комплекса, порядок реакции совпадает с молекулярностью, а кинетическое уравнение процесса – с законом действующих масс. К реакциям подобного типа относятся реакции:
–диссоциации 2HJ → H2 + J2, 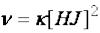 ;
;
–соединения NO + O3 = NO2 + O2, 
К сложным реакциям относятся реакции, протекающие последовательно или параллельно через несколько стадий. Скорость реакции будет определять самая медленная (лимитирующая) стадия процесса. Например, реакция разложения N2O5, 2N2O5 = 4NO2 + O2 протекает через несколько стадий:
N2O5 ↔ NO2+ NO3 (быстрая стадия);
NO2 + NO3 → NO2 + NO + O2 (медленная стадия); NO + NO3 ↔ 2NO2 (быстрая стадия).
Лимитирующей является вторая (бимолекулярная) стадия
процесса:  , порядок реакции в данном случае (n = 1 + 1 = 2)
, порядок реакции в данном случае (n = 1 + 1 = 2)
совпадает с молекулярностью суммарной реакции разложения N2O5, однако такое равенство не всегда имеет место.
В последнее время все больше внимания уделяется периодическим процессам (колебательным реакциям). Такие периодические процессы характеризуются колебаниями концентраций некоторых промежуточных соединений и, соответственно, скоростей этих стадий процесса. Реакции были открыты в середине прошлого века Б.П. Белоусовым (Россия).
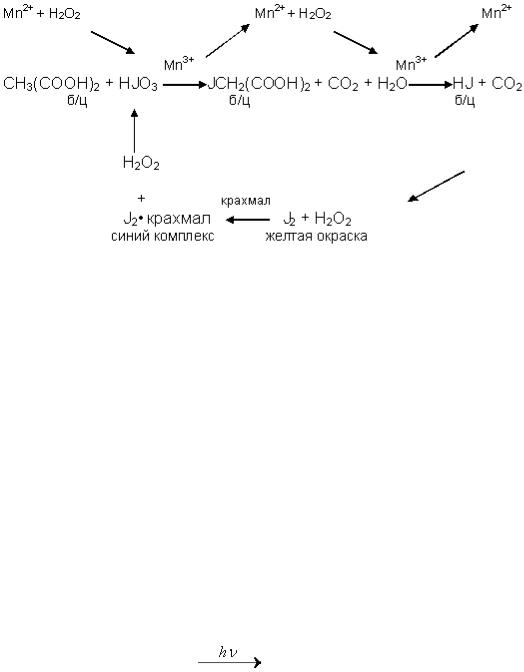
Примером подобных процессов является реакция окисления малоновой кислоты СН3(СООН)2 избытком перекиси водорода Н2О2 в присутствии иодат ионов JO3– и ионов марганца Mn2+, играющих роль катализатора, а также индикатора – крахмала. На рис. 37 представлена схема протекания этого процесса.
Рис. 37. Схема колебательной реакции окисления малоновой кислоты
Входе реакции окраска раствора периодически меняется: желтая, темно-синяя, бесцветная, – затем цикл повторяется. Колебания прекращаются после полного
окисления малоновой кислоты. Изменение окраски связано с периодическим изменением концентрации: JO3–, J2, J2∙крахмал. Период колебаний зависит от концентрации веществ и температуры процесса.
Механизм протекания колебательных реакций очень сложен и объясняется на основе термодинамически необратимых процессов.
Вначале прошлого века российские ученые Н.А. Шилов и Н.Н. Семенов разработали теорию цепных реакций. Такие реакции встречаются часто: горение топлива в двигателях внутреннего сгорания, реакции полимеризации, реакции, протекающие в атмосфере и пр.
Цепные реакции начинаются со стадии инициирования, т. е. образования активных частиц (свободных радикалов), которые представляют собой осколки молекул, имеющих неспаренные электроны: Cl*, O*, HS* и др. Свободные радикалы образуются при воздействии на систему света, тепла, излучения высокой энергии, либо в ходе экзотермических процессов (горение органического топлива в двигателях внутреннего сгорания). Появление свободных радикалов называется стадией зарождения цепи. Далее идет рост цепи – радикалы взаимодействуют с молекулами, образуя продукты реакции и новые радикалы. Процесс заканчивается обрывом цепи, когда радикалы, взаимодействуя друг с другом или с молекулами, образуют другие нейтральные молекулы.
Пример: H2 + Cl2 = 2HCl, |
|
|
– зарождение цепи |
Cl2 |
2Сl*, |
– рост цепи |
Cl* + H2 → HCl + H* |
|
|
H* + Cl2 → HCl + Cl*, |
|
– обрыв цепи |
H* + H* → H20 |
|
Cl* + H* → HCl.

На скорость цепной реакции влияет объем и форма сосуда, в которой она протекает, инертные примеси и ряд других факторов.
ЗАКЛЮЧЕНИЕ
Химия – это естественная наука, которая включает в себя большую область человеческих знаний. В первой части данного учебного пособия в краткой форме излагаются основные понятия и количественные законы химии, квантово-механическая модель атома, теории химической связи в молекулах и твердых веществах, элементы химической термодинамики, основные законы химической кинетики и химического равновесия. Однако в таких разделах химии, как катализ, химия твердого тела и др. существует еще много нерешенных задач.
Взначительной мере благодаря фундаментальным законам химии разрабатываются новые области промышленности и технологии: полупроводниковая техника, соединения, обладающие высокотемпературной сверхпроводимостью, твердые электролиты со специфическими свойствами, производство интегральных и компьютерных схем, средства телекоммуникаций, новые источники энергии и пр. Серьезные и ответственные задачи стоят перед химией в решении экологических проблем.
Вданном учебном пособии приведены некоторые примеры решения подобных задач.
Все рассмотренные разделы в учебном пособии представлены как в историческом аспекте их развития, так и с позиций современных научных открытий в рассматриваемых областях, а также дополнены образцами решения конкретных задач по материалу разделов и индивидуальными самостоятельными заданиями.
Полученные в курсе химии теоретические знания будут полезны студентам при изучении теоретических основ различных технологических процессов в электротехнике, электронике, микроэлектронике, материаловедении, приборостроении и пр.
Невозможно предусмотреть все задачи, в решении которых специалистам потребуются химические знания. Однако понимание основных законов химии, умение пользоваться научной и справочной литературой позволят специалистам находить оптимальные решения стоящих перед ними задач, в том числе с использованием законов химии, химических процессов и веществ.
ПРИЛОЖЕНИЕ
Таблица 1
Важнейшие кислоты и их соли
Формула |
Названия |
|
кислоты |
кислоты |
соли |
HAlO2 |
метаалюминиевая |
метаалюминаты |
H3AsO4 |
ортомышьяковая |
ортоарсенаты |
H3AsO3 |
ортомышьяковистая |
ортоарсениты |
HBO2 |
метаборная |
метабораты |
H3BO3 |
ортоборная |
ортобораты |
HBr |
бромоводород |
бромиды |
HOBr |
бромноватистая |
гипобромиты |
НBrO3 |
бромноватая |
броматы |
HCOOH |
муравьиная |
формиаты |
CH3COOH |
уксусная |
ацетаты |
HCN |
циановодород |
цианиды |
|
|
|

H2CO3 |
угольная |
карбонаты |
HCl |
хлороводород |
хлориды |
HOCl |
хлорноватистая |
гипохлориты |
HClO2 |
хлористая |
хлориты |
HClO3 |
хлорноватая |
хлораты |
HClO4 |
хлорная |
перхлораты |
HCrO2 |
метахромистая |
метахромиты |
H2CrO4 |
хромовая |
хроматы |
H2Cr2O7 |
двухромовая |
дихроматы |
HJ |
йодоводород |
йодиды |
HOJ |
йодноватистая |
гипойодит |
HJO3 |
йодная |
перйодаты |
HMnO4 |
марганцовая |
перманганаты |
H2MnO4 |
марганцовистая |
манганаты |
H2MoO4 |
молибденовая |
молибдаты |
HNO2 |
азотистая |
нитриты |
HNO3 |
азотная |
нитраты |
HPO3 |
метафосфорная |
метафосфаты |
H3PO4 |
ортофосфорная |
ортофосфаты |
H4P2O7 |
двуфосфорная |
пирофосфаты |
H3PO3 |
фосфористая |
фосфиты |
H3PO2 |
фосфорноватистая |
гипофосфиты |
H2S |
сероводород |
сульфиды |
HSCN |
родановодород |
роданиды |
H2SO3 |
сернистая |
сульфиты |
H2SO4 |
серная |
сульфаты |
H2S2O3 |
тиосерная |
тиосульфаты |
H2Se |
селеноводород |
селениды |
H2SeO4 |
селеновая |
селенаты |
H2SiO3 |
кремниевая |
силикаты |
HVO3 |
ванадиевая |
ванадаты |
H2WO4 |
вольфрамовая |
вольфраматы |
Таблица 2
Константы диссоциации некоторых электролитов в водных растворах при 25 °С
Название |
Формула |
|
|
|
|
|
|
Азотная кислота |
HNO3 |
43,6 |
|
Азотистая кислота |
HNO2 |
4 ∙ 10–4 |
|
Бромоводород |
HBr |
109 |
|
Гидроксид аммония |
NH4OH |
2 ∙ 10–5 |
|
Иодоводород |
HI |
1011 |
|
Кремниевая кислота |
H2SiO3 |
10–10 |
|
Муравьиная кислота |
HCOOH |
2 ∙ 10–4 |
|
Ортофосфорная кислота |
H3PO4 |
8 ∙ 10–3 |
|
Серная кислота |
H2SO4 |
103 |
|
Сернистая кислота |
H2SO3 |
2 ∙ 10–2 |
|
Сероводород |
H2S |
6 ∙ 10–8 |
|
Угольная кислота |
H2CO3 |
4.5 ∙ 10–7 |
|
Уксусная кислота |
CH3COOH |
2 ∙ 10–5 |
|
Фтороводород |
HF |
7 ∙ 10–4 |
|
Хлороводород |
HCl |
107 |
|
П р и м е ч а н и е: для многоосновных кислот константа диссоциации |
дана по |
||
первой ступени диссоциации. |
|
|
|

Таблица 3
Растворимость кислот, оснований и солей в воде
|
Ионы |
|
OH– |
|
NO3– |
|
F– |
|
Cl– |
Br– |
J– |
|
S2– |
|
SO32– |
SO42– |
|
CO32– |
|
SiO32– |
|
PO43– |
CrO42– |
CH3COO– |
||
|
H+ |
|
|
|
P |
|
P |
|
P |
P |
P |
|
P |
|
P |
P |
|
P |
|
H |
|
P |
P |
P |
||
|
Li+ |
|
P |
|
P |
|
P |
|
P |
P |
P |
|
P |
|
P |
P |
|
P |
|
P |
|
H |
P |
P |
||
|
NH4+ |
|
P |
|
P |
|
P |
|
P |
P |
P |
|
P |
|
P |
P |
|
P |
|
P |
|
P |
P |
P |
||
|
K+ |
|
P |
|
P |
|
P |
|
P |
P |
P |
|
P |
|
P |
P |
|
P |
|
P |
|
P |
P |
P |
||
|
Na+ |
|
P |
|
P |
|
P |
|
P |
P |
P |
|
P |
|
P |
P |
|
P |
|
P |
|
P |
P |
P |
||
|
Ag+ |
|
– |
|
P |
|
P |
|
H |
H |
H |
|
H |
|
M |
M |
|
M |
|
H |
|
H |
H |
P |
||
|
Ba2+ |
|
P |
|
P |
|
M |
|
P |
P |
P |
|
– |
|
M |
H |
|
M |
|
H |
|
H |
H |
P |
||
|
Ca2+ |
|
M |
|
P |
|
H |
|
P |
P |
P |
|
– |
|
M |
M |
|
H |
|
M |
|
H |
M |
P |
||
|
Mg2+ |
|
H |
|
P |
|
H |
|
P |
P |
P |
|
– |
|
M |
P |
|
M |
|
– |
|
M |
P |
P |
||
|
Zn2+ |
|
H |
|
P |
|
M |
|
P |
P |
P |
|
H |
|
M |
P |
|
– |
|
H |
|
H |
H |
P |
||
|
Mn2+ |
|
H |
|
P |
|
M |
|
P |
P |
P |
|
H |
|
H |
P |
|
H |
|
H |
|
H |
H |
P |
||
|
Cu2+ |
|
H |
|
P |
|
H |
|
P |
P |
– |
|
H |
|
– |
P |
|
– |
|
– |
|
H |
H |
P |
||
|
Cu+ |
|
H |
|
P |
|
– |
|
P |
– |
– |
|
– |
|
H |
P |
|
– |
|
– |
|
H |
– |
P |
||
|
Hg+ |
|
– |
|
P |
|
H |
|
H |
H |
H |
|
H |
|
H |
M |
|
H |
|
– |
|
H |
– |
P |
||
|
Hg2+ |
|
– |
|
P |
|
M |
|
P |
M |
– |
|
H |
|
– |
– |
|
H |
|
– |
|
H |
– |
P |
||
|
Pb2+ |
|
H |
|
P |
|
H |
|
M |
M |
H |
|
H |
|
H |
M |
|
H |
|
H |
|
H |
H |
P |
||
|
Fe2+ |
|
H |
|
P |
|
M |
|
P |
P |
P |
|
H |
|
M |
P |
|
H |
|
H |
|
H |
– |
P |
||
|
Fe3+ |
|
H |
|
P |
|
P |
|
P |
P |
P |
|
H |
|
– |
P |
|
– |
|
– |
|
M |
– |
P |
||
|
Al3+ |
|
H |
|
P |
|
P |
|
P |
P |
P |
|
– |
|
– |
P |
|
– |
|
– |
|
H |
– |
P |
||
|
Cr3+ |
|
H |
|
P |
|
P |
|
P |
P |
– |
|
– |
|
– |
P |
|
– |
|
– |
|
H |
– |
P |
||
|
Bi3+ |
|
H |
|
P |
|
H |
|
– |
– |
– |
|
H |
|
H |
P |
|
H |
|
H |
|
H |
H |
P |
||
|
Sn2+ |
|
H |
|
– |
|
P |
|
P |
P |
M |
|
H |
|
H |
P |
|
– |
|
– |
|
H |
– |
P |
||
|
Sr2+ |
|
M |
|
P |
|
M |
|
P |
P |
P |
|
P |
|
H |
H |
|
H |
|
H |
|
H |
M |
P |
||
|
P – растворимые; M – малорастворимые; H – нерастворимые; – разлагаются водой |
|||||||||||||||||||||||||
|
или не существуют. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Таблица 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Двенадцать элементарных кирпичиков, составляющих материю |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Фундаментальные |
|
|
Лептоны |
|
|
|
|
|
|
|
|
|
Кварки |
|
|
|
|||||||||
|
фермионы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Электрический |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
заряд |
|
|
|
|
|
|
–1 |
|
|
|
|
|
0 |
|
|
|
|
+ 2/3 |
|
|
–1/3 |
|
|||
|
Частицы |
|
|
|
|
Первое семейство |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
окружающего |
|
|
электрон – |
|
|
электронное |
|
u-кварк (up – |
d-кварк(down |
||||||||||||||||
|
мира |
|
|
|
|
|
|
переносчик |
|
|
нейтрино – |
|
|
верхний) – |
– нижний) – |
|||||||||||
|
принадлежат этой |
|
|
электрического |
|
играет фунда- |
|
входит в |
|
входит в |
||||||||||||||||
|
группе |
|
|
|
|
|
|
тока, |
|
|
|
|
|
ментальную |
|
|
состав |
|
состав прото- |
|||||||
|
|
|
|
|
|
|
|
|
М = |
|
|
|
|
|
роль при |
|
|
протонов и |
нов и нейтро- |
|||||||
|
|
|
|
|
|
|
|
|
= 0,511 МэВ/с2 |
|
|
горении |
|
|
нейтронов, |
нов, |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Солнца, |
|
|
М = 3 МэВ/с2 |
М = 6Мэв/с2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
каждую се- |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кунду сквозь |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нас |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пролетают |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
миллиарды |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
этих частиц |
|
|
|
|
|
|
|
|
||
|
Эти частицы |
|
|
|
|
Второе семейство |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
существовали |
|
мюон – |
|
|
|
мюонное ней- |
|
c-кварк(charm |
|
s- |
|
|
||||||||||
|
в первый момент |
аналог электрона, |
|
трино – |
|
|
– оча- |
|
|
|
кварк(strange |
||||||||||||
|
после Большого |
время жизни 2 |
|
|
бразуется при |
|
рованный) – |
|
– странный) – |
||||||||||||||
|
взрыва. |
|
|
микросекунды, |
|
|
рождении и |
|
|
открыт |
|
|
открыт |
|
|||||||||
|
Теперь их можно |
М = 106 МэВ/с2 |
|
|
распаде |
|
|
в1974 г., |
|
|
в 1964 г., |
|
|||||||||||
|
обнаружить |
|
|
|
|
|
|
мюонов, |
|
|
М = 1300 |
|
|
М = 100 МэВ/с2 |
|||||||||
|
в космосе и на ус- |
|
|
|
|
|
М < 0,2 МэВ/с2 |
|
МэВ/с2 |
|
|
|
|
|
|||||||||
|
корителях |
|
|
Третье семейство |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
частиц |
|
|
Тау-лептон – |
|
|
Тау-нейтри- |
|
t-кварк (top – |
|
b-кварк(beauty |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
аналог электрона, |
|
но – |
|
|
|
|
самый |
|
|
– прелестный) |
|||||||
|
|
|
|
|
|
время жизни – |
|
|
образуется |
|
|
верхний или |
|
– открыт |
|
||||||||
|
|
|
|
|
|
3∙10–13, |
|
|
|
при рождении |
|
truth – |
|
|
|
в 1977 г., |
|
||||||
|
|
|
|
|
|
М = |
|
|
|
|
и распаде тау |
|
истинный) – |
|
М = |
|
|
||||||
|
|
|
|
|
|
= 1777 МэВ/с2 |
|
|
лептонов, |
|
|
открыт |
|
|
= 4 300 МэВ/с2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
открыто |
|
|
в 1995 г., |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
в1975 г. |
|
|
М = 175 000 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
М < 20 МэВ/с2 |
|
МэВ/c2 |
|
|
|
|
|
|||||
|
Таблица 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Электроотрицательность элементов по Полингу |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li |
Be |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В |
C |
|
N |
O |
F |
|
1,0 |
1,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,0 |
2,5 |
|
3,0 |
3,5 |
4,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na |
Mg |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Al |
Si |
|
P |
S |
Cl |
|
0,9 |
1,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,5 |
1,8 |
|
2,1 |
2,5 |
3,0 |
|
K |
Ca |
|
Sc |
Ti |
V |
Cr |
Mn |
Fe |
|
Co |
Ni |
|
Cu |
|
Zn |
|
Ga |
Ge |
|
As |
Se |
Br |
|
0,8 |
1,0 |
|
1,3 |
1,5 |
1,6 |
1,6 |
1,5 |
1,8 |
|
1,9 |
1,9 |
|
1,9 |
|
1,6 |
|
1,6 |
1,8 |
|
2,0 |
2,4 |
2,8 |
|
Rb |
Sr |
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
|
Rh |
Pd |
|
Ag |
|
Cd |
|
In |
Sn |
|
Sb |
Te |
I |
|
0,8 |
1,0 |
|
1,2 |
1,4 |
1,6 |
1,8 |
1,9 |
2,2 |
|
2,2 |
2,2 |
|
1,9 |
|
1,7 |
|
1,7 |
1,8 |
|
1,9 |
2,1 |
2,5 |
|
Cs |
Ba |
|
La |
Ра |
Ta |
W |
Re |
Os |
|
Ir |
Pt |
|
Au |
|
Hg |
|
Tl |
Pb |
|
Bi |
Po |
At |
|
0,7 |
0,9 |
|
1,0 |
1,3 |
1,5 |
1,7 |
1,9 |
2,2 |
|
2,2 |
2,2 |
|
2,4 |
|
1,9 |
|
1,8 |
1,9 |
|
1,9 |
2,0 |
2,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 6
Значения термодинамических функций
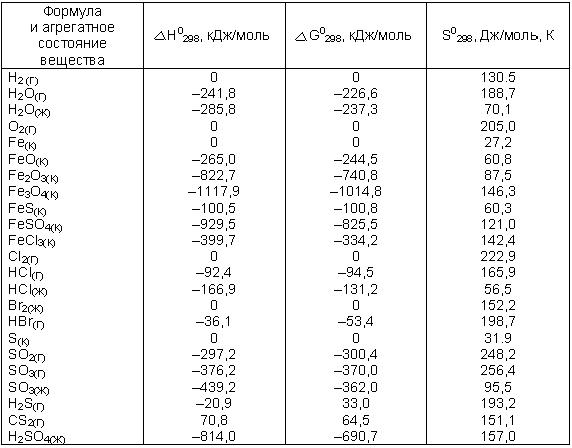
Продолжение табл. 6
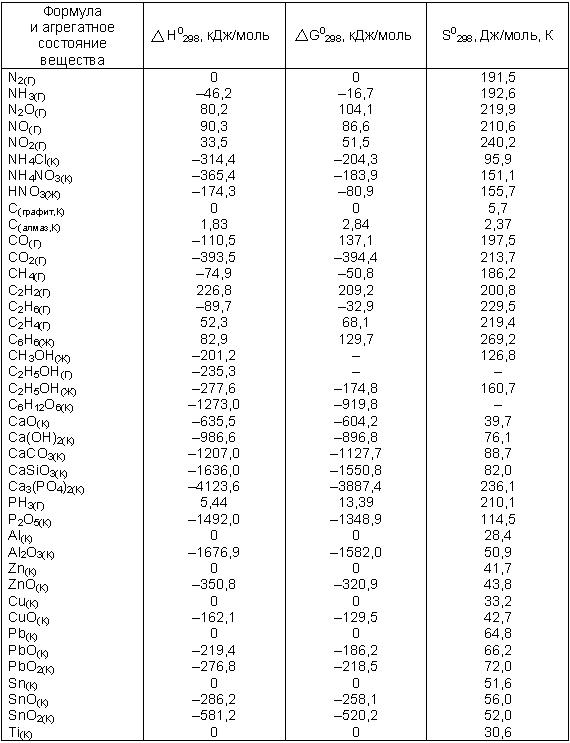
Окончание табл. 6
