
10028
.pdf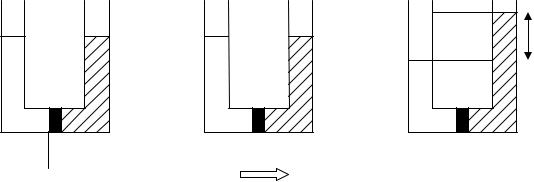
11
магнитные поля, ультразвуковая и гидродинамическая кавитация. Уровень энергетического воздействия можно охарактеризовать производимым результатом: разрушение структуры или перестройка структуры. Изменить некоторые свойства воды можно и сверхслабыми внешними воздействиями, правда, эти изменения пока не идентифицируются физико-химическими методами, а фиксируются лишь косвенными проявлениями на живых биологических системах.
1.3. Водные растворы
Вода – прекрасный растворитель, и вся земная жизнь протекает в водных растворах. Человечество постепенно выстраивает представление о том, что такое раствор, и наши соотечественники – М.В.Ломоносов и Д.И.Менделеев были одними из первых. Оценивая вклад Д.И.Менделеева в эту проблему, академик Н.А.Морозов писал, что «после периодической системы элементов химическая теория растворов – это самое важное его достижение».
Развитие теории растворов связано с одним, по тем временам загадочным явлением, получившим название «осмос». Впервые его наблюдал и открыл в 1748 году профессор физики в Париже аббат Ж.Нолле (1700-1770). Сосуд с вином плотно закрывали пленкой животного происхождения и помещали воду. Через некоторое время пленка разрывалась, т.е. через нее в сосуд втягивалась вода и повышалось давление до разрушения пленки.
Немецкий физиолог В.Пфеффер (1845-1920) продолжил изучение осмоса и установил, что втягивание воды через пленку, во-первых, происходит до некоторого равновесия, которое он определил количественно в следующем эксперименте (рис.1.10). Эта величина получила название «осмотическое давление раствора».
Рис.1.10. Схема эксперимента по определению осмотического давления
Во-вторых, Пфеффер обнаружил, что химический состав раствора не меняется после разбавления его водой, т. е. пленка обладает селективностью (избирательностью) по проникающим компонентам. Появился термин «полупроницаемая мембрана». Однако Пфеффер не смог установить количественные зависимости осмотического давления от концентрации и
12
температуры.
В 1886 году известный физико-химик Я.Вант-Гофф (1852-1911) в журнале шведской академии наук опубликовал работу под названием «Химическое равновесие в системах газов и разведенных растворов». В конце концов открытый им закон формулировался так: Свойства разбавленных растворов (температура кипения, температура замерзания, плотность, осмотическое давление) изменяются прямо пропорционально молекулярной
концентрации растворенного вещества». |
|
||
Уравнение Вант-Гоффа: |
|
||
|
|
π = i c R T |
(1.1) |
где π – |
осмотическое давление; |
|
|
i |
– |
коэффициент Вант-Гоффа; |
|
c |
– |
мольная концентрация; |
|
R – |
газовая постоянная; |
|
|
T – |
абсолютная температура |
|
|
Эмпирический коэффициент Вант-Гоффа в дальнейшем развитии теории |
|||
оказался тем узелком, на котором все сошлось. Для NaCl, |
KCl – i = 2, для |
||
Na2SO4 – i = 3. Экспериментально это было определено, а объяснений не было, пока к разработке теории растворов не подключился шведский физико-химик С.Аррениус (1859-1927).
То, что предложил Аррениус, разрушало все основы теоретической химии. Принципиальным считалось, что молекула сложного вещества представляет собой очень прочное соединение, атомы в котором связаны могучими силами химического сродства. Растворение вещества в воде представляли как его распределение в объеме в виде отдельных молекул.
Аррениус же утверждал, что вещество в воде самопроизвольно распадается на свободные ионы. Сегодня в это трудно поверить, но тогда много лет теория электролитической диссоциации считалась бредом, о ней было неприлично говорить вслух.
Закончилось все тем, что в 1903 году Аррениус получил Нобелевскую премию за свою теорию, но сам превратился в ретрограда, поскольку в 1889 году Д.И.Менделеев опубликовал свою работу «Заметки о диссоциации растворенных веществ». Там утверждалось, что после диссоциации ионы вступают во взаимодействие с молекулами воды и существуют в растворах в виде гидратов. Аррениус же и большинство других ученых считали, что молекулы Н2О нейтральны и связываться с ионами не могут.
Современное представление электролитической диссоциации – это полный или частичный распад молекул растворяемого вещества на катионы и анионы, который происходит в полярных растворителях и касается наиболее полярных связей.
Основные причины диссоциации – сольватация ионов и резкое ослабление электростатического взаимодействия между ионами за счет диэлектрической проницаемости воды. Понятно, что энергия сольватации существенно больше, чем энергия кристаллической решетки.
13
По причине электролитической диссоциации понижается давление пара воды над раствором, снижается температура замерзания и повышается температура кипения по сравнению с чистой водой.
1.4. Растворы неэлектролитов в воде
Наиболее простым типом неэлектролита являются инертные газы. Относительно растворов таких веществ в воде Аррениус был совершенно прав, поскольку между молекулами газа и воды могут существовать лишь очень слабые ван-дер-ваальсовы взаимодействия. Т.о. такой раствор представляет собой почти идеальную смесь.
Где же размещаются молекулы газов в воде ? Вспомним, что структура водных кластеров ажурна, т.е. внутри водных тетраэдров и между ними существуют полости, куда и внедряются молекулы неэлектролитов. При этом структура воды укрепляется.
Таким образом, положение каждой неводной молекулы довольно строго локализовано, а число пустот, т.е. растворимость вещества, ограничено. Образование раствора газа представляется как простое заполнение микрополостей, которые в воде уже имеются в готовом виде. Количество этих полостей зависит от физических условий – температуры и давления.
1.5. Растворы электролитов в воде
Наука о растворах – одна из наиболее старых областей естествознания. Принцип алхимии – « Тела не действуют друг на друга, если они не растворены». В современной химии исследование растворов, т.е. систем со слабым химическим взаимодействием, позволило понять механизм электрической поляризации, вязкого течения, передачи звука, переноса энергии возбуждения и т.д.
Строение и свойства жидких систем зависят от взаимодействий между молекулами. Жидкости занимают определенный объем и сопротивляются сжатию потому, что между молекулами действуют силы отталкивания. Образование жидкой фазы при конденсации паров происходит благодаря силам притяжения.
Все силы можно разделить на близкодействующие и дальнодействующие. К близкодействующим относятся силы отталкивания, природа которых заключается в сжатии электронных оболочек атомов и росте их кинетической энергии, и химические связи, образующиеся в результате обобществления электронов при сближении частиц. Энергия химических связей может достигать 400 кДж/моль, т.е. они очень велики.
Дальнодействующие силы – это электростатическое взаимодействие между заряженными частицами и силы Ван-дер-Ваальса. Водородная связь также относится к этим силам и величина ее может достигать 20-30 кДж/моль.
После диссоциации ионы в воде имеют свои электрические поля. Электрическое поле иона не может не повлиять на ориентацию дипольных
14
молекул воды, а, значит, исказить или даже разрушить первоначальную структуру. Но одновременно ион создает новую упорядоченность молекул воды, строит новую структуру. Разрушение старой структуры увеличивает энтропию системы, строительство новой структуры энтропию уменьшает.
Как располагаются молекулы Н2О вокруг иона? Очевидно, что точечный электрический заряд создает равномерное сферическое поле, и дипольные молекулы окружают центр лучистым способом, т.е. ориентируются по радиусам. В 1906 году уникальный русский ученый – энциклопедист Н.А.Морозов в ряде статей обосновал существование в таких комплексах двух слоев (или оболочек) гидратированной воды, не зная еще о дипольном характере молекулы воды (что стало известно лишь полвека спустя).
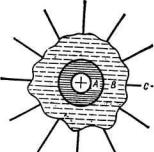
В 50-х годах американцы Г.Фрэнк и М.Эванс предложили простую модель двухслойной гидратной оболочки иона. В этой модели вокруг иона существует три концентрические зоны (рис.1.11).
Рис.1.11. Простая модель двухслойной гидратной оболочки иона: А – ион с прочно связанными молекулами Н2О; В – участок разрушенной структуры; С – структурно
нормальная вода.
Оболочка А достаточно прочная, строго упорядоченная под действием электрического поля иона, молекулы воды «заморожены». В зоне С сохранена тетраэдрическая структура чистой воды, промежуточная зона В – зона «таяния», где сказывается влияние обеих соседних зон. Толщина слоя А определяется плотностью заряда иона (отношением величины заряда иона к его диаметру).
Присутствие в растворе заряженных частиц, на первый взгляд, сводит задачу объяснения сольватации к взаимодействию точечного заряда со средой. Однако более глубокие исследования растворов (ЭПР, ЯМР) говорят о создании новых структур внутри гидратных слоев, и даже о протекании химических процессов – происходит перестройка внешних электронных оболочек ионов и молекул воды вплоть до образования донорно-акцепторных связей.
Спустя некоторое время слой А стал называться слоем первичной гидратации или первичной гидратной оболочкой. В процессе электролиза он движется вместе с ионом. Вторичная гидратация с ионом связана не прочно.
Рассмотрим, что происходит при концентрировании раствора (рис.1.12). Если в разбавленном растворе слой С существует (поз.1), то по мере добавления электролита сначала исчерпывается свободная вода (поз. II), затем

15
и слой вторичной гидратации (поз. III).
Рис.1.12. Модель водного раствора в широком диапазоне концентраций.
В очень разбавленных растворах влияние поля отдельного иона распространяется на довольно значительные расстояния. Можно рассчитать среднее межионное расстояние в растворах различной концентрации, результаты представлены в табл.1.
|
|
|
|
|
Таблица 1.1 |
|||
|
Средние межионные расстояния в растворе 1-1-электролита |
|
|
|||||
Концентрация, |
|
|
|
|
|
|
|
|
моль/л |
0,001 |
|
0,01 |
0,1 |
1,0 |
|
10,0 |
|
Межионное |
|
|
|
|
|
|
|
|
расстояние, Å |
94 |
|
44 |
20 |
9,4 |
|
4,4 |
|
Т.о. уже в 1-молярном |
р-ре между ионами может разместиться 2,0-2,5 |
|||||||
молекулы воды, т.е. вокруг каждого иона – 1 слой молекул воды. |
|
|
||||||
Число молекул воды в первой сольватной оболочке называют |
||||||||
координационным числом сольватации |
nк. Ясно, что по чисто геометрическим |
|||||||
соображениям число молекул растворителя, непосредственно связанных с ионом, должно быть ограниченным. Многочисленные исследования привели к принятым сегодня значениям nк в слое А (первой сольватной оболочке) для различных ионов: Na+ - 6; K+ - 6; RB+ - 8; Cs+ - 8; NH+4 - 4; Mg 2+ - 6; Sr2+ - 6; Ba2+ - 6; Ce3+ - 9 и т.д.
На рисунке 1.13 представлена модель структуры первой гидратной оболочки катиона Ме2+ в концентрированном растворе МеCl2.

16
Рис.1.13. Схема строения первой гидратной оболочки Ме2+.
Анионы удерживают вокруг себя молекулы воды немного слабее. В
разбавленных растворах nк для различных анионов имеет значение от 4 до 10, в концентрированных растворах они раньше теряют гидратные оболочки и сами пристраиваются к сольватным комплексам катионов.
В 1951 году советский физико-химик К.П.Мищенко ввел в обиход понятие «граница полной гидратации» - ГПГ для водных растворов. После того как были установлены координационные числа для различных электролитов, появилась возможность вычислить концентрации электролитов, когда вся имеющаяся в растворе вода включена в состав первых гидратных оболочек. Структурно такой раствор можно схематически представить в виде системы, составленной только из однослойно гидратированных ионов, соприкасающихся друг с другом своими гидратными оболочками. Для разных электролитов эта концентрация находится в интервале от 2,14 до 4,63 моль/л.
Понятно, что на ГПГ должно происходить принципиальное изменение многих свойств растворов. Во-первых, размеры ассоциатов легко вычисляются, расстояния между ионами лежат в интервале 6-8 Ǻ. Если отсюда вычесть размеры ионов, определенные рентгено-структурными методами изучения кристаллов, то получим точное значение удвоенной величины диаметра молекулы воды.
При разбавлении раствора молекулы воды начинают выстраивать вторичную гидратную оболочку. Расстояние от них до центрального иона увеличивается минимум на 2,8Ǻ. Отсюда следует, что второй слой молекул воды значительно слабее связан с ионом (если r2 для первого слоя ~ 8Å 2; то для второго - 31Å 2). Тем не менее энергия связи молекул второго слоя с центральным ионом довольно существенна. Если для первичной гидратации она составляет порядок 11-13 ккал/моль, т.е. заметно выше теплоты испарения
17
воды (9-10 ккал/моль), то для вторичной гидратации энергия связи – 6-8 ккал/моль.
Во второй гидратной оболочке ионов координационные числа – от 12 до 40. Это зависит от многих обстоятельств: увеличение заряда иона увеличивает координационное число, рост ионного радиуса его уменьшает, разбавление раствора и понижение его температуры увеличивает координационное число.
Та концентрация раствора, когда вся имеющаяся вода входит в первичную и вторичную гидратные оболочки, называется границей дальней гидратации – ГДГ.
1.6. Энергетические эффекты растворения
Взаимодействие |
растворителя |
с |
растворяемым |
веществом |
||
сопровождается изменением энтальпии системы: |
|
|
||||
|
ΔН = Нr (m1H1 + m2H2) |
|
|
(1.2) |
||
где Нr |
– полная энтальпия образовавшегося раствора; |
|
||||
Н1 |
– |
энтальпия одного моля растворителя; |
|
|||
Н2 |
– |
энтальпия одного моля растворяемого вещества; |
|
|||
m1 и m2 – количество молей растворителя и растворяемого вещества
в растворе.
Отнесенная к одному молю растворенного вещества величина ΔН/m2 = Hm называется интегральной теплотой растворения.
Обычно мы имеем дело с концентрированием и разбавлением раствора. Поэтому тепловой эффект таких процессов будет определяться из разницы интегральных теплот растворения двух систем – конечной и начальной:
ΔНmкmн = ΔН mк – ΔН mн ≠ 0 |
(1.3) |
Эта разница называется интегральной |
теплотой разведения |
(концентрирования) раствора.
В основе тепловых эффектов лежит перестройка структур чистых веществ при образовании ими раствора, т.е. распад на ионы (диссоциация) растворенного вещества и разрушение кластерной системы воды, раздвигание молекул для размещения между ними ионов электролита, а затем строительство гидратных оболочек ионов.
Величины Н1 и Н2 в уравнении 1.2 – эндотермические, а Нr - экзотермическая. От их соотношения зависит общий тепловой эффект процесса растворения. Для различных электролитов общая величина интегральной теплоты разведения по-разному зависит от концентрации раствора (рисунок
1.14).

18
Рис. 1.14. Зависимость интегральных теплот разведения некоторых 1-1-валентных солей в воде при 25оС от концентрации. Штриховая линия – теоретический предельный наклон.
Разработаны методики расчета и экспериментального измерения теплот растворения, что позволяет получать информацию о структуре и свойствах растворов.
1.7. Осмотическое давление раствора
Эксперименты, поставленные аббатом Ноле и затем Пфеффером, продемонстрировали стремление раствора вобрать в себя растворитель. Количественно это выражалось высотой столба жидкости, достигнутой при состоянии равновесия на установке, схема которой приведена на рисунке 1.10. Сейчас уже мы понимаем, какие силы заставляют молекулы растворителя проникать через мембрану, преодолевая противодавление столба жидкости, - это силы гидратации ионов и молекул растворенного вещества.
Движущей силой любого переноса вещества из одного состояния в другое ( в нашем случае через мембрану) является в общем виде разность химических потенциалов. Химический потенциал i-го компонента в смеси
µ i = µ io + RT ln ai + ViP |
(1.4) |
где µ iо – химический потенциал одного моля чистого вещества, аi – активность,
19
Vi – молярный объем.
Рассмотрим
(рис.1.15).
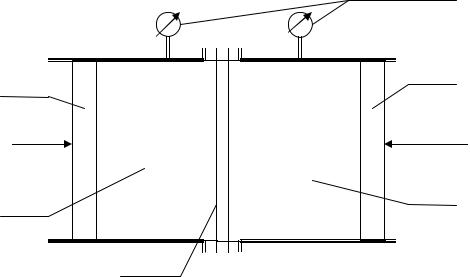
устройство прибора, который называется осмометром
Р
Ф Ф
Рис. 1.15. Схема осмометра – прибора для измерения осмотического давления: 1 – камера раствора; 2 – камера растворителя; 3 – полупроницаемая мембрана; 4,5 – поршни, 6 – манометры.
Химические потенциалы растворителя в фазе 1 и в фазе 2 при
достижении равновесия равны: |
|
µ 1о + RT ln a1 + V1P1 = µ 2o + RT ln a2 + V2P2 |
(1.5) |
До тех пор, пока потенциалы не сравняются, будет происходить перенос растворителя из фазы 2 в фазу 1, а при фиксированном объеме камеры 1 в ней за счет переноса будет повышаться давление. При достижении равновесия
Р1 = Р2 + π |
(1.6) |
где π – приращение давления за счет осмоса.
То давление, которое надо создать в растворе для предотвращения
переноса в него растворителя через |
полупроницаемую мембрану, называется |
|||
осмотическим давлением раствора. |
|
|
||
В уравнении 1.5 |
µ 1о = µ 2о, |
а молярные объемы V1 ~ V2 |
и для чистого |
|
растворителя, и для |
малоконцентрированного раствора. Поэтому его можно |
|||
преобразовать следующим образом: |
|
|
||
RT (ln a2 – ln a 1) |
= |
πV |
(1.7) |
|
20
В камере 2 находится чистый растворитель, т.е. а2 = 1. В камере 1 – раствор, для которого с учетом закона Рауля (активность компонента равна его молярной доле) можно записать следующее преобразование:
|
ln a1 = ln y1 = ln (1-x1) = -x1 |
(1.8) |
|
где у1 – молярная доля растворителя в растворе; |
|
||
х1 – молярная доля растворенного вещества в растворе, |
|
||
тогда выражение 1.7 можно записать: |
|
|
|
|
X1 |
|
|
π = RT · ---- |
(1.9) |
|
|
|
V |
|
|
|
N мол. pаств.в-ва |
А |
|
Учтем, что х1 = ----------------------------, а размерность V = -------------------, |
|||
|
N мол.растворителя |
моль раств-ля |
|
Тогда выражение 1.9 запишем в виде уравнения Вант-Гоффа: |
|
||
|
N мол.раств.вещ-ва |
m |
|
π = RT · -------------------------- = С· RT = ---- · RT |
(1.10) |
||
|
V растворителя |
M |
|
где С – |
молярная концентрация растворенного вещества в растворе; |
|
|
m – |
массовая концентрация растворенного вещества; |
|
|
М – |
его молекулярная масса. |
|
|
Наконец, вспомним, что для растворов диссоциирующих электролитов в уравнение 1.10 добавляется поправочный коэффициент i, который практически равен числу образующихся в растворе ионов.
Таким образом, осмотическое давление является мерой степени перестройки структуры воды при внесении в нее растворяемых компонентов. Связи молекул воды с вносимыми в нее веществами по механизму и по энергетике зависят в основном от свойств вносимого вещества, но возникают они всегда.
Проведем расчет величины осмотического давления для различных веществ, возникающего при внесении их в воду.
Пример 1.1. Определить величину π водопроводной воды: солесодержание (по NaCl)
– 0,5 г/л, температура – 10 оС. |
|
|
|
|
Молекулярная масса – 58,5; ТоК = 283; R = 8,31; |
i = 2. |
|||
0,5 |
|
|
|
|
π = 2 · ----------- · 8,31 · 283 = 40·103 |
Па = 0,4 бар. |
|
||
58·5·10-3 |
|
|
|
|
Проверим размерность: |
|
|
|
|
моль |
дж |
дж |
н |
|
[π] = ------ |
· ---------- · оК = ------ = --- |
= Па |
||
м3 |
моль·оК |
м3 |
м2 |
|
