
8041
.pdf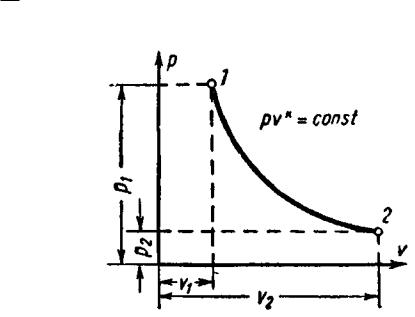
|
|
|
|
40 |
|
(82): |
|
|
|
|
|
l RT ln |
p1 |
2,303RT lg |
p1 |
2,303 287 303 lg10 200 кДж/ кг. |
|
p2 |
p2 |
||||
|
|
|
Количество теплоты, отводимой от газа, равно работе, затраченной на сжатие. Следовательно,
q 200 кДж/ кг.
6.4 Адиабатный процесс
Уравнение адиабаты в системе координат p-v (рис. 6) при постоянной теплоемкости (сv = const) для идеального газа
pvk const,
где k cp – показатель адиабаты. cv
Рис. 6
Зависимости между начальными и конечными параметрами процесса:
между p и v
p |
2 |
v |
k |
|
||
|
|
1 |
|
, |
(89) |
|
|
|
|
||||
p1 |
v2 |
|
|
|
||

41
между T и v
k 1
TT2 vv1 ,
1 2
между p и T
|
|
|
|
|
k 1 |
|
T |
|
p |
|
k |
|
|
|
2 |
|
2 |
. |
||
|
T1 |
p1 |
||||
|
|
|
|
|
||
Работу 1 кг газа находят по следующим формулам:
l |
|
1 |
|
|
( p v |
p v ); |
|||||||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
k 1 |
1 |
1 |
|
|
2 |
2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
p v |
|
|
|
v |
1 |
k 1 |
|
||||||||||||
l |
|
1 1 |
1 |
|
|
|
|
|
|
; |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
k 1 |
|
|
v2 |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
|
|
R |
|
(T |
T ); |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
k 1 |
1 |
|
|
2 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k 1 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
p v |
|
|
|
|
p |
|
k |
|
|
|
|||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|||||||||||
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||||||
l |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
. |
||||
k 1 |
|
p |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(90)
(91)
(92)
(93)
(94)
(95)
Для определения работы M кг газа нужно в формулах (92), (93) и (95)
заменить удельный объем v общим объемом V газа. Тогда получим
L |
1 |
|
( p V p V ); |
|
|||||||||||
|
|
|
|
||||||||||||
|
|
k 1 |
1 |
1 |
|
|
2 |
2 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
p V |
1 |
|
|
|
V |
1 |
k 1 |
|
|||||
L |
|
1 |
1 |
|
|
|
|
|
|
|
; |
||||
|
|
|
|
|
|
|
|
||||||||
|
|
k 1 |
|
|
V2 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k 1 |
|
|
|
|
|
p V |
|
|
|
|
p |
|
k |
|
|
||||
|
|
1 |
|
|
|
|
|
||||||||
|
1 |
|
|
|
|
2 |
|
|
|
|
|||||
L |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
. |
|
|
k |
1 |
p |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Формула (94) для M кг газа примет следующий вид:
L kMR1(T1 T2 ).
Уравнение первого закона для адиабатного процесса имеет вид
(96)
(97)
(98)
(99)

42
0 du dl,
следовательно,
du dl |
|
или |
|
u l, |
(100) |
т. е. изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку.
Изменение внутренней энергии идеального газа в адиабатном процессе
может быть также выражено уравнением |
|
u cvm (t2 t1). |
(101) |
Задача
1 кг воздуха при начальной температуре t1 = 30 °С и давлении р1 = 0,1 МПа сжимается адиабатно до конечного давления р2 = 1 МПа.
Определить конечный объем, конечную температуру и затрачиваемую работу.
Решение
Из соотношения параметров в адиабатном процессе по уравнению (91)
находим
|
|
|
|
|
k 1 |
|
T |
|
p |
|
|
|
|
k |
||||||
|
2 |
|
2 |
. |
||
|
T1 |
p1 |
||||
|
|
|
|
|
||
Откуда
|
|
|
|
|
k 1 |
|
|
|
|
p |
|
k |
|
T2 |
T1 |
|
2 |
. |
||
p1 |
||||||
|
|
|
|
|
||
Принимая k = 1,4, получаем
0,4
T2 303 101,4 303 100,286 303N;
lg N lg100,286 0, 286 lg10 0, 286;

43
N 1,931;
T2 303 1,931 585 |
К; t2 312 C. |
k 1 |
|
|
p2 |
k |
|
|
|
|
|
|
|
|
|
p1 |
|
|
|
|
|
|
|
|
|
Значение величины |
|
можно взять справочной литературы. |
||||||||
|
|
|
|
|
|
|
|
|
k 1 |
|
|
|
|
|
p2 |
|
|
p |
|
k |
|
|
|
|
|
10 |
|
2 |
|
|
1,931. |
|
|
|
|
|
p1 |
||||||
|
|
|
|
p1 |
||||||
Для адиабатного сжатия при |
|
|
величина |
|
|
|
||||
Затраченная работа по уравнению (94)
l k R 1(T1 T2 ) 0,0,2874 (303 585) 202 кДж/ кг.
Конечный объем определяется из уравнения состояния
v2 RT2 287 585 0,168 м2 / кг. p2 1 106
6.5 Политропный процесс
Уравнение политропы в системе координат p-v (рис. 7) при постоянной теплоемкости
pvm const,
где т – показатель политропы.
Характеристикой политропного процесса является величина
φ qu ,
которая может быть определена из выражения
φ mm k1 ,
где k cp . cv
(102)
(103)
Пользуясь рис. 8, можно по величине показателя политропы определить ее относительное расположение в диаграмме p-v, а также выяснить характер процесса, т. е. имеет ли место подвод или отвод теплоты и увеличение, или
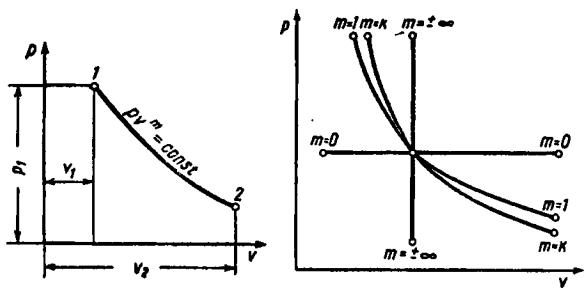
44
уменьшение внутренней энергии газа.
Рис. 7 |
Рис. 8 |
Для процессов расширения
а) т < 1 – теплота подводится (q > 0), внутренняя энергия газа увеличивается (Δи > 0);
б) k > т > 1 – теплота подводится (q > 0), внутренняя энергия газа уменьшается (Δи < 0);
в) т > k – теплота отводится (q < 0), внутренняя энергия газа уменьшается (Δи < 0).
Для процессов сжатия
а) т < 1 – теплота отводится, внутренняя энергия газа уменьшается;
б) k > т > 1 – теплота отводится, внутренняя энергия газа увеличивается;
в) т > k – теплота подводится, внутренняя энергия газа увеличивается.
Зависимости между начальными и конечными параметрами процесса:
между p и v
p |
v |
m |
||
2 |
|
1 |
|
; |
p1 |
|
|||
v2 |
|
(104) |
||
|
|
|
|
|
45
между T и v
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
v1 |
m 1 |
; |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v2 |
|
|
|
|
|
|
(105) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
между p и T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m 1 |
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
p |
m |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
. |
|
|
||||||||
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
p1 |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(106) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работу 1 кг газа в политропном процессе определяют по следующим |
|||||||||||||||||||||||||||||||||
формулам: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
1 |
|
|
|
|
|
( p v p |
v ); |
(107) |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
m 1 |
|
1 |
1 |
|
|
2 |
|
2 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
p v |
|
|
|
|
v |
|
m 1 |
|
||||||||||||||||||
l |
|
1 |
1 |
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
; |
(108) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
m 1 |
|
|
|
v2 |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m 1 |
|
|
|
||||||
|
|
|
p v |
|
|
|
|
p |
m |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
1 1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|||||||||||||||
l |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
; |
(109) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
m |
1 |
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
l |
|
R |
|
|
|
(T T ). |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
m 1 |
|
1 |
|
|
|
|
2 |
|
|
|
(110) |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если количество теплоты, участвующей в процессе, известно, то |
|||||||||||||||||||||||||||||||||
работа может быть также вычислена по формуле |
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
l |
k 1 |
q. |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
m 1 |
|
|
|
|
|
|
(111) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для определения работы М кг газа нужно в формулах (107) - (109) |
|||||||||||||||||||||||||||||||||
заменить удельный объем v полным объемом газа V. Тогда |
|
||||||||||||||||||||||||||||||||
L |
|
1 |
|
|
|
|
( p V p V ); |
(112) |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
m |
1 |
|
|
1 |
1 |
|
|
|
|
2 |
2 |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
p V |
|
|
|
|
|
|
|
V |
m 1 |
|
|
||||||||||||||||||
L |
|
|
|
|
1 1 |
|
1 |
|
|
1 |
|
|
|
|
; |
(113) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
m 1 |
|
|
|
|
|
V2 |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||

46
|
|
|
|
|
|
|
|
|
|
|
m 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
p V |
|
p |
m |
|
|
||||||||
|
|
|
|
|
|
|
|||||||||
|
1 |
1 |
|
|
|
2 |
|
|
|
|
(114) |
||||
L |
|
|
|
|
1 |
|
|
|
|
|
. |
||||
|
|
|
|
|
|
|
|||||||||
|
|
m 1 |
|
|
|
|
p |
|
|
|
|
||||
|
|
|
|
|
|
|
1 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Формулы (110) и (111) для М кг имеют следующий вид: |
|
||||||||||||||
|
L |
MR |
(T T ); |
|
|
|
|||||||||
|
|
|
|
|
|||||||||||
|
|
|
m 1 |
1 |
2 |
|
|
|
(115) |
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L k 1 Q. |
|
m 1 |
(116) |
|
Теплоемкость политропного процесса можно найти из уравнения (102)
c cφv
или, заменяя φ его значением из уравнения (103), c cv mm k1 .
Количество теплоты, сообщаемой газу или отнимаемой от него:
q c(t |
|
t ) c |
m k |
(t |
|
t |
); |
|
|||||||
|
|
|
|
|
|||||||||||
|
|
2 |
1 |
v |
m 1 |
|
2 |
|
|
1 |
|
|
(117) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q Mc(t |
|
t ) Mc |
|
m k |
(t |
|
t |
). |
(118) |
||||||
|
|
|
|
|
|||||||||||
|
2 |
|
1 |
|
v m 1 |
|
|
|
2 |
|
1 |
|
|
||
Величину Q можно также определить из формулы (116), если известна
работа политропного процесса:
Q L |
k m |
. |
|
|
|
||
|
k 1 |
(119) |
|
|
|
|
|
Изменение внутренней энергии газа в политропном процессе находим |
|||
или по общей для всех процессов формуле |
|
||
u ccm (t2 t1)
или по формулам
u φq mm 1k q;
u m 1l. 1 k

47
Показатель политропного процесса т определяется из уравнения
m cp c . cv c
Если известны значения двух параметров в начальном и конечном состоянии, то, пользуясь уравнениями (104) - (106), можно найти значение т из формул:
|
|
|
lg |
|
p1 |
|
|
|
|
|
||||||||
m |
|
p2 |
; |
|
|
|
(120) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
lg |
|
v |
2 |
|
|
|
|
|
|
|
|||||
|
|
|
|
v1 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
lg |
T2 |
|
|
|
|
||||||||
m 1 |
|
T1 |
|
; |
(121) |
|||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
v |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
lg |
|
|
1 |
|
|
|
|
||||||
|
|
|
v2 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
lg |
T2 |
|
|
|
|
||||||||
m 1 |
|
|
|
|
|
. |
(122) |
|||||||||||
|
|
|
|
|
|
T1 |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
m |
|
|
lg |
|
|
|
p2 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
p1 |
|
|
|
|
|||||||
Показатель политропы может быть также определен из уравнения (103).
Решая его относительно т, получаем
m |
kφ 1 |
. |
(123) |
|
|||
|
φ 1 |
|
|
В справочных материалах для облегчения расчетов приведены наиболее часто встречающиеся значения величин
1
p2 mp1
m 1
иp1 m .p2
Задача
1 кг воздуха при р1 = 0,5 МПа и t1 = 111 °С расширяется политропно до давления р2 = 0,1 МПа.
Определить конечное состояние воздуха, изменение внутренней энергии,

48
количество подведенной теплоты и полученную работу, если показатель политропы т=1,2.
Решение
Определяем начальный объем воздуха:
v |
RT1 |
|
287 |
384 |
0, 22 м3 / кг. |
|
|
|
|||
1 |
p |
0,5 |
106 |
||
|
|||||
|
1 |
|
|
|
|
Конечный объем воздуха находим из уравнения (104):
|
|
|
|
1 |
1 |
|
|||
|
|
|
|
|
|
|
|||
|
|
|
p |
m |
0,84 м3 / кг. |
||||
|
|
|
|
||||||
|
|
0, 22 51,2 |
|||||||
v2 |
v1 |
|
1 |
|
|||||
p2 |
|||||||||
|
|
|
|
|
|
|
|||
Конечную температуру проще всего получить из характеристического уравнения
|
|
|
|
|
|
|
p v |
0,1 106 0,84 |
|
||
|
|
|
T |
|
|
2 2 |
|
|
293 К. |
||
|
|
|
|
|
|
|
|||||
|
|
|
|
2 |
|
|
R |
287 |
|
||
|
|
|
|
|
|
|
|
|
|||
Величину работы находим из уравнения (110): |
|||||||||||
l |
R |
(T T ) |
287 |
(384 293) 130600 Дж/ кг 130,6 кДж/ кг. |
|||||||
|
|
|
|
|
|
||||||
|
m 1 |
1 2 |
0, 2 |
|
|
|
|
|
|||
Изменение внутренней энергии
u cv (T2 T1) 28,9620,93 (293 384) 65,8 кДж/ кг.
Количество теплоты, сообщенной воздуху, по уравнению (117)
q c |
m k |
(t |
|
t |
) 0,72 |
1, 2 1, 4 |
(20 111) 65,8 кДж/ кг. |
|
|
|
|||||
v m 1 |
|
2 |
1 |
|
1, 2 1 |
|
|
Нетрудно видеть, что в этом процессе внешняя работа совершается за счет подведенной теплоты и уменьшения внутренней энергии. Исходя из этого,
можно проверить полученные результаты следующим образом: q u l;
l q u 65,8 ( 65,8) 131,6 кДж/ кг.
Этот же результат нами получен выше другим путем.

49
7. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Второй закон термодинамики определяет направление, в котором протекают процессы, устанавливает условия преобразования тепловой энергии в механическую, а также определяет максимальное значение работы, которая может быть произведена тепловым двигателем.
Второй закон термодинамики математически может быть выражен следующим образом:
dS |
dQ |
, |
(124) |
|
T |
||||
|
|
|
где dS – бесконечно малое приращение энтропии системы; dQ – бесконечно малое количество теплоты, полученной системой от источника теплоты; Т –
абсолютная температура источника теплоты.
Знак неравенства соответствует необратимым процессам, а знак равенства – обратимым процессам. Следовательно, аналитическое выражение второго закона термодинамики для бесконечно малого обратимого процесса имеет вид
dQ TdS, |
(125) |
|
а так как согласно первому закону термодинамики dQ dU pdV ,
то уравнение (125) принимает вид
TdS dU pdV .
7.1 Энтропия идеального газа
Основным уравнением для определения изменения энтропии в обратимом процессе является выражение
ds dq . |
|
T |
(126) |
Поскольку в технической термодинамике приходится иметь дело не с абсолютным значением энтропии, а с ее изменением, отсчет значений энтропии
