
7137
.pdf
21
РАЗДЕЛ 3.
ПРОЦЕСС КОАГУЛИРОВАНИЯ ВОДЫ
3.1. Общая часть
Метод коагуляции играет важную роль в процессах водоочистки и предназначен для удаления взвешенных коллоидных частиц и мелкодисперсных примесей, обусловливающих мутность и цветность воды. Особенно эффективен процесс коагуляции в области коллоидной дисперсности, к которой относятся частицы, имеющие размер от 10-9 до 10-7 м. Это гуминовые вещества, мельчайшие глинистые и пылевидные частицы.
Коллоидные частицы равномерно распределены по всему объему воды, из-за своего маленького размера постоянно находятся в состоянии броуновского движения и вследствие этого в естественных условиях не оседают под действием сил тяжести.
Коллоидные системы отличаются большой устойчивостью и, поэтому процесс слипания частиц сам по себе протекает очень медленно. Устойчивость их объясняется наличием у всех частиц одноименного электрического заряда, который препятствует столкновению и слипанию их в более крупные агрегаты.
Для устранения этого препятствия в обрабатываемую воду, содержащую обычно отрицательно заряженные частицы, вводят коагулянты, образующие, положительно заряженные коллоиды. Взаимодействие противоположно заряженных коллоидных частиц приводит к нейтрализации их зарядов и образованию более крупных частиц в виде хлопьев.
Коагулянты – это соли, образованные слабым основанием и сильной кислотой, которые попадая в воду, подвергаются гидролизу с образованием труднорастворимых гидроокисей. В качестве коагулянтов применяют сульфат алюминия АI2(SО4)3, оксихлорид алюминия Aln(OH)mCl3n-m, хлорид железа FеСl3; смешанный коагулянт, состоящий из сульфата алюминия и хлорида железа, взятых в соотношении 1:1. Реже применяют сульфат железа (III) Fe2(SО4)3 и железа (II) FeSО4, а также алюминат натрия NaAlO2. Характеристики некоторых коагулянтов приведены в Приложении 2.
Гидролиз кислого коагулянта сопровождается образованием кислоты в количестве, эквивалентном активной концентрации раствора коагулянта.
Гидролиз сульфата алюминия (полная реакция): Al2(SO4)3 + 6H2O 2Al(OH)3 + 3H2SO4
2Al(OH)3 + 3H2SO4
Гидролиз хлорида железа (III) (полная реакция): FeCl3 + 3H2O  Fe(OH)3 + 3HCl
Fe(OH)3 + 3HCl
Гидролиз оксихлорида алюминия (моногидроксохлорида Al): Al(OH)Cl2 + 2H2O  Al(OH)3
Al(OH)3 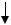 + 2HCl
+ 2HCl
Появление в растворе в результате гидролиза кислоты и связанное с этим повышение концентрации ионов Н+ тормозят гидролиз. Необходимым

22
условием для протекания реакции гидролиза в сторону образования гидрооксидов алюминия и железа является связывание выделяющейся при гидролизе кислоты в малодиссоциированное соединение. В природных водах протекание гидролиза коагулянта обеспечивается так называемым щелочным резервом воды, т.е. наличием в воде определенного количества ионов НСО3- (гидрокарбонат-ионов).
Гидрокарбонат кальция Са(НСО3)2 превращает выделяющуюся при гидролизе коагулянта кислоту в малодиссоциированную угольную кислоту, которая распадается на углекислый газ и воду.
Са(НСО3)2 + Н2SО4  СаSО4 + 2Н2СО3 Н2СО3
СаSО4 + 2Н2СО3 Н2СО3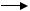 СО2
СО2  + Н2О
+ Н2О
Суммарное уравнение реакции:
Аl2(SO4)3 + 3Са(НСО3)2  2Аl(ОН)3
2Аl(ОН)3 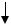 + 3CaSO4 + 6CO2
+ 3CaSO4 + 6CO2
При гидролизе 1 мг сульфата алюминия расходуется 0,017 мг-экв ионов НСО3- (или 0,017 мг-экв щелочности), а 1 мг хлорида железа (III) - 0,018 мг-экв щелочности.
Гидролиз коагулянтов протекает довольно быстро, в течение первых 30 секунд после введения коагулянта в воду он заканчивается образованием коллоидных гидроксидов алюминия и железа. Образовавшиеся коллоидные системы коагулянтов адсорбируют на своей поверхности вещества, загрязняющие воду, и захватывают их при своем осаждении, что и приводит к осветлению и обесцвечиванию, а также к улучшению санитарнобактериологических показателей воды.
Важным условием эффективности коагуляции является правильный выбор дозы коагулянта. При избытке коагулянта в воде остается непрореагировавший Al2(SO4)3, вода приобретает кислый вкус и становится мутной. При недостатке коагулянта образуется мало хлопьев и не достигается требуемая степень очистки воды.
Расчетные дозы коагулянтов для предварительных ориентировочных расчетов могут приниматься согласно рекомендациям [2] в зависимости от цветности и мутности воды. Эти дозы часто существенно отличаются от доз, необходимых для обработки данной воды. Оптимальную дозу реагента, обеспечивающую достижение необходимого эффекта осветления, устанавливают на основе технологического анализа воды используемого источника - пробным коагулированием. Метод экспериментального определения доз коагулянта является наиболее достоверным, дающим возможность получить воду необходимого качества с учетом остаточных концентраций загрязнений от природной взвеси и нерастворимой части вводимых реагентов.
Оптимальной дозой коагулянта называется наименьшая доза его, обеспечивающая достижение необходимого эффекта осветления и
23
обесцвечивания воды (цветность очищенной воды 20 0С и мутность 1,5 мг/л). Оптимальная доза коагулянта зависит от величины цветности воды, мутности и щелочности. Определяя оптимальную дозу, следует учитывать характер процессов образования и оседания хлопьев, щелочность очищенной воды, а также остаточные концентрации ионов коагулянта (Fe3+, Al3+).
Эффективность процессов осветления и обесцвечивания воды коагуляцией зависит от целого ряда факторов (температуры воды, солевого состава воды, концентрации примесей и степени их диспергирования, рН воды и ее щелочности, времени и интенсивности перемешивания и др.), которые в значительной степени влияют на глубину очистки.
Значительное влияние на процесс коагулирования оказывает температура воды. При низких температурах в зимнее время очистка воды коагулянтами (особенно Аl2(SO4)3) ухудшается: замедляются процессы хлопьеобразования и осаждения хлопьев, хлопья образуются мелкие, в очищенной воде появляется остаточный алюминий в концентрациях выше допустимых. Объясняется это либо замедлением процесса хлопьеобразования (т.е. собственно коагуляции), либо замедлением скорости гидролиза Аl2(SO4)3. С увеличением температуры (подогрев воды), увеличивается подвижность частиц (возможность их столкновения и слипания), тем самым процесс коагулирования убыстряется, а, следовательно, осветление и обесцвечивание воды улучшается.
Заметное улучшение хлопьеобразования достигается при перемешивании растворов. Процесс медленного перемешивания способствует убыстрению роста коллоидных частиц гидроокисей, получаемых при гидролизе коагулянтов, что ведет к лучшему их слипанию, а, следовательно, коагуляции.
Для быстрого и полного протекания гидролиза коагулянтов необходим некоторый щелочной резерв воды. В тех случаях, когда количество гидрокарбонат-ионов, содержащихся в воде, недостаточно для полного гидролиза коагулянта, щелочность воды повышают введением известкового молока Са(ОН)2 или, при обосновании, раствора кальцинированной соды Na2CO3 согласно п. 9.24 [2]. Реагенты следует вводить одновременно с вводом коагулянтов.
Дозы подщелачивающих реагентов Дщ, мг/л, необходимых для улучшения процесса хлопьеобразования, следует определять согласно п. 9.16 [2].
Дщ = Кщ · (Дк/ек – Щ0) +1, мг/л,
где - Дк максимальная в период подщелачивания доза безводного коагулянта, мг/л;
ек - эквивалентная масса коагулянта (безводного), принимаемая для
Аl2(SO4)3 - 57, FeCl3 - 54, Fe2(SO4)3 - 67 мг/мг-экв;
Кщ - коэффициент, равный для извести (по СаО) - 28, для соды (по
Na2CO3) - 53;
Щ0 - минимальная щелочность воды, мг-экв/л.
Практика показывает, что в мутных водах хлопья образуются быстрее и лучше, чем в прозрачных. Поэтому иногда для ускорения процесса в камеры хлопьеобразования специально вводят замутнители (мелкоизмельченный песок,
24
каолин и т.д.). Или, например, используют неочищенный кусковой реагент Аl2(SO4)3, тем самым повышая мутность исходной воды.
Сцелью увеличения эффективности процесса коагулирования и возможности снижения необходимой дозы коагулянта проводят предварительную обработку воды окислителями.
Сцелью интенсификации процесса обработки воды коагулянтами применяют метод фракционного (дробного или частичного) коагулирования воды, при котором коагулянт добавляют к очищаемой воде двумя или несколькими порциями. В этом случае увеличивается период образования положительно заряженных коллоидных частиц гидроксидов коагулянтов. Рекомендованный оптимальный промежуток времени между введением отдельных частей коагулянта 90-120 с [4]. При обесцвечивании воды первая доза коагулянта должна составлять половину общей. На первом этапе образуются мелкие агрегаты, которые хорошо сорбируют окрашивающие примеси. Образованию мелких хлопьев способствует также интенсивное механическое перемешивание в течение 30-60 с при введении первой дозы коагулянта.
Флокуляция является наиболее эффективным способом интенсификации очистки воды методом коагулирования. Введение в обрабатываемую воду дополнительных вспомогательных химических веществ (флокулянтов) улучшают процесс хлопьеобразования и сокращают время образования хлопьев.
Флокуляция - это процесс, во время которого частицы, образованные на стадии коагуляции, собираются в агрегаты, при этом их взаимодействие происходит через молекулы адсорбированного флокулянта.
Флокулянты представляют собой высокомолекулярные частицы со способностью к адсорбции. Стоит отметить, что процесс флокуляции, который должен начаться вслед за процессом коагуляции, потребует очень малого количества химических реагентов (0,01 - 0,5 мг/л). Даже при использовании небольшого количества флокулянт способен в значительной степени интенсифицировать образование хлопьев, делая их более плотным и тяжелыми, и, соответственно, быстро осаждаемыми. Использование флокулянтов позволяет ограничивать дозировку коагулянтов, сократить продолжительность отстаивания, повысить производительность осветлителей со слоем взвешенного осадка, увеличить грязеёмкость фильтров и контактных осветлителей.
Флокулянты принято разделять на органические и неорганические. К неорганическому типу, применяемому в промышленности на сегодняшний день, можно отнести кремниевую кислоту. Органические же можно выделить в две основные группы: синтетические и природные водорастворимые линейные полимеры анионного, катионного, амфотерного и неионогенного типа. Природные флокулянты – это целлюлоза, крахмал и их производные. Синтетические флокулянты (полиакрилы, полиамины, полиамиды) наиболее популярны, они дешевле, обладают лучшими флокулирующими свойствами, их производство связано с меньшими затратами, получаются из продуктов
25
переработки нефти и газа. Широко распространенные синтетические флокулянты это полимеры и сополимеры акриламида, например, ПАА – полиакриламид. Характеристики некоторых флокулянтов приведены в Приложении 3.
3.2. Лабораторная работа №5 Пробное коагулирование воды. Сравнение эффективности работы двух
коагулянтов
Цель работы: провести пробное коагулирование и определить оптимальную дозу коагулянта для осветления и обесцвечивания исследуемой воды, и выявить наиболее эффективный коагулянт путем сравнения сульфата алюминия и оксихлорида алюминия.
Методика выполнения работы
1.В исследуемой воде определяют цветность, мутность, рН.
2.В 6 цилиндров наливают по 250 мл хорошо перемешанной исследуемой воды.
3.Затем в цилиндры 1, 2, 3 добавляют раствор коагулянта Аl2(SO4)3 известной концентрации в дозах 10, 20, 30 мг/л. В цилиндры 4, 5, 6 добавляют
раствор коагулянта Аl(ОН)Cl2 известной концентрации в дозах 10, 20, 30 мг/л. Заданные дозы коагулянта в мг/л переводят в мл, используя формулу:
Q = (D·V) / C, мл
где Q - количество раствора реагента (коагулянта), мл; D - доза коагулянта, мг/л;
V - объем обрабатываемой воды, л;
С - концентрация раствора коагулянта, мг/л или г/л.
Определение активной концентрации раствора коагулянта (в перерасчете на Al2O3) определяется объемным методом по ниже приведенной методике.
4.Содержимое цилиндров после добавления реагента энергично перемешивают 10-кратным опрокидыванием, а затем медленным помешиванием стеклянной палочкой, чтобы не препятствовать хлопьеобразованию, в течение 2-3 минут.
5.По окончании перемешивания цилиндры оставляют в покое на 30
минут.
6.При отстаивании воды в цилиндрах наблюдают кинетику образования хлопьев, время начала и конца их оседания, а также вид хлопьев (рыхлые, крупные, мелкие). Наблюдения проводят через каждые 15 мин.
При добавлении к воде раствора коагулянта на основе Al на первой стадии процесса происходит гидролиз с образованием коллоидной гидроокиси
алюминия Al(OH)3. Коллоидные частицы гидроокиси алюминия сорбируют из раствора отдельно находящиеся в нем ионы Al+3 и приобретают при этом положительный заряд. Так как находящиеся в растворе взвешенные коллоидные и мелкодисперсные вещества в основном заряжены отрицательно,
26
то под действием сил притяжения происходит образование агрегатов в виде хлопьев. На следующей стадии образовавшиеся хлопья сорбируют на себя загрязняющие воду вещества, увеличиваясь в размере, и осаждаются вместе с ними, очищая воду.
Наименьшая доза коагулянта, при которой получаются хорошие хлопья через 15 мин и достаточно полное оседание их в течение 30 минут отстоя (при этом качество воды согласуется с требованиями потребителя), считается оптимальной.
7.Для определения качества обработанной коагулянтами воды с помощью пипетки или сифона из верхней части цилиндров отбирают пробы отстоянной воды для определения мутности, цветности, рН и остаточного алюминия по соответствующим методикам анализа [6].
8.Результаты анализов и наблюдений заносят в табл. 6.
9.На основании полученных результатов дается заключение о ходе очистки воды коагулянтами, определяется наиболее эффективный коагулянт и его оптимальная доза для обработки данной воды.
|
|
|
|
|
|
|
Таблица 6 |
|
|
|
Результаты анализов |
|
|
|
|
||
Наименование |
Исходная |
|
|
№ цилиндра |
|
|
|
|
вода |
1 |
2 |
3 |
4 |
5 |
|
6 |
|
|
|
|||||||
Реагент |
|
|
Аl2(SO4)3 |
|
|
Аl(ОН)Cl2 |
||
Доза, D, мг/л |
|
|
|
|
|
|
|
|
Кол-во, Q, мл |
|
|
|
|
|
|
|
|
Цветность, 0С |
|
|
|
|
|
|
|
|
Мутность, мг/л |
|
|
|
|
|
|
|
|
рН |
|
|
|
|
|
|
|
|
Аl3+, мг/л |
|
|
|
|
|
|
|
|
|
|
Визуальные наблюдения |
|
|
|
|
||
15 мин |
|
|
|
|
|
|
|
|
30 мин |
|
|
|
|
|
|
|
|
Определение активной концентрации растворов коагулянтов
Активная концентрация в пересчете на Al2O3 раствора коагулянта определяется объемным методом. Под активной концентрацией понимают то количество коагулянта в единице объема, которое подвергается гидролизу. Гидролиз кислого коагулянта (сульфата алюминия, оксихлорида алюминия, пентагидроксохлорида алюминия, хлорида алюминия) сопровождается образование кислоты в количестве, эквивалентном активной концентрации раствора коагулянта.
Ход определения:
1 см3 раствора коагулянта разбавляют дистиллированной водой до 50 см3, добавляют 2 капли 1%-ного спиртового раствора фенолфталеина и титруют 0,5Н раствором NaOH до устойчивого розового окрашивания раствора.

27
Содержание оксида алюминия Al2O3 (Х) в мг/дм3 рассчитывают по формуле:
Х = v ∙ N ∙ Э ∙ 1000 / V, мг/дм3
где: v - количество0,5Н раствора NaOH, пошедшее на титрование пробы раствора коагулянта, см3;
N - нормальность расвора NaOH; Э - эквивалент Al2O3 (Э = 17);
V - объем раствора коагулянта, взятый для определения, см3.
Блок-схема определения концентрации Al+3 (ГОСТ 18165-14)
Сущность метода заключается в образовании окрашенного в оранжевокрасный цвет комплексного соединения ионов алюминия с алюминоном.
Если проба не консервировалась при отборе, ее подкисляют перед анализом концентрированной соляной кислотой из расчета 3 см3 HCl на 1дм3 воды и выдерживают 15 мин., если вода питьевая или природная, и 2ч, если вода сточная.
Мерная колба V=50 см3
Vпробы =25 см3
*При концентрации алюминия ≥ 0,5 мг/дм3 берут 10 или 5 см3 пробы, разбавляя ее до 25 см3 подкисленной дистиллированной водой ( 3 см3 HClконц на 1л воды)
+ 25 см3 реакционной смеси
Перемешивание и выдержка 25-30 мин
Фотометрирование по отношению к холостой пробе
(подкисленная, 3 см3 HCl на 1дм3, дистиллированная вода + все этапы
по ходу анализа)
=540 нм, l=30мм
Приготовление реакционной смеси: Смешивают в соотношении 1:2:22 объемные части растворов сульфата аммония (С=33,3%) , алюминона (С=2г/дм3) и разбавленного в 10 раз ацетатного буферного раствора (рН=4,9). В день анализа в смеси растворяют аскорбиновую кислоту по 30 мг на каждые 25 см3 смеси.
Аскорбиновая кислота устраняет мешающее влияние Fe+3, образующего аналогично окрашенное соединение.
28
3.3. Лабораторная работа №6 Исследование влияния флокулянтов на процесс коагулирования воды
Цель работы: провести пробное коагулирование и подобрать оптимальные дозы реагентов (коагулянта и флокулянта) для осветления и обесцвечивания воды. Изучить влияние флокулянтов на процесс коагулирования. Сравнить работу двух флокулянтов.
Методика выполнения работы
1.В исследуемой воде определяют цветность, мутность, рН.
2.В 4 цилиндра наливают по 250 мл хорошо перемешанной исследуемой воды.
3.Затем в цилиндры 1, 2, 3, 4 добавляют раствор коагулянта Аl2(SO4)3 известной концентрации в дозах соответственно D1 = 10 мг/л, D2 = 20 мг/л, D3 = 10 мг/л, D4 = 10 мг/л. Заданные дозы коагулянта в мг/л переводят в мл (см. л.р. №5).
4.Содержимое цилиндров после добавления реагента энергично перемешивают 10-кратным опрокидыванием. Затем медленным помешиванием стеклянной палочкой, чтобы не препятствовать хлопьеобразованию, в течение 2-3 минут перемешиваем содержимое цилиндров 1, 2.
5.Через 1 минуту после ввода коагулянта в цилиндры 3, 4 вводим разные марки флокулянтов в дозах 1-2 мг/л. Заданные дозы флокулянтов в мг/л переводят в мл (см. л.р. №5).
6.Содержимое цилиндров 3, 4 после добавления флокулянта энергично перемешивают 10-кратным опрокидыванием, а затем медленным помешиванием стеклянной палочкой, чтобы не препятствовать хлопьеобразованию, в течение 2-3 минут.
7.По окончании перемешивания все цилиндры оставляют в покое на 30 минут. При отстаивании воды в цилиндрах отмечают время начала образования хлопьев, время начала и время конца их оседания, а также вид хлопьев (рыхлые, крупные, мелкие). Наблюдения проводят через каждые 15 мин.
8.Для определения качества обработанной воды с помощью пипетки или сифона из верхней части цилиндров отбирают пробы отстоянной воды для определения мутности, цветности, рН и остаточного алюминия по соответствующим методикам анализа [6].
9.Результаты анализов и наблюдений заносят в табл. 7.
10.На основании полученных результатов дается заключение о ходе очистки воды коагулянтами с добавлением флокулянтов, определяется наиболее эффективный флокулянт.
29
|
|
|
|
|
|
|
Таблица 7 |
|
|
|
Результаты анализов |
|
|
||
Наименование |
Исходная |
|
|
№ цилиндра |
|
||
вода |
1 |
|
2 |
3 |
4 |
||
|
|
|
|||||
Реагент |
|
|
|
|
Аl2(SO4)3 + |
Аl2(SO4)3 + |
|
|
|
|
Аl2(SO4)3 |
|
флокулянт |
флокулянт |
|
|
|
|
|
|
|
марки 1 |
марки 2 |
Доза |
коагулянта, |
|
|
|
|
|
|
D, мг/л |
|
|
|
|
|
|
|
Кол-во коагулянта, |
|
|
|
|
|
|
|
Q, мл |
|
|
|
|
|
|
|
Доза |
флокулянта, |
|
|
|
|
|
|
D, мг/л |
|
|
|
|
|
|
|
Кол-во |
|
|
|
|
|
|
|
флокулянта, Q, мл |
|
|
|
|
|
|
|
Цветность, 0С |
|
|
|
|
|
|
|
Мутность, мг/л |
|
|
|
|
|
|
|
рН |
|
|
|
|
|
|
|
|
|
|
Визуальные наблюдения |
|
|
||
15 мин |
|
|
|
|
|
|
|
30 мин |
|
|
|
|
|
|
|
Вопросы для самопроверки к разделу 3.
1.В чем заключается сущность процесса коагулирования воды с целью ее осветления и обесцвечивания?
2.Описать реакции гидролиза коагулянтов Аl2(SO4)3 и Аl(ОН)Cl2?
3.Что называется оптимальной дозой коагулянта, как ее устанавливают?
4.От каких факторов зависит эффективность процесса коагулирования воды?
5.В чем заключается роль подщелачивающих реагентов в процессе коагулирования воды?
6.Как влияет температура обрабатываемой коагулянтами воды на процесс осветления и обесцвечивания воды?
7.Какое влияние оказывает интенсивность и время перемешивания на процесс коагулирования?
8.В чем заключается сущность процесса флокуляции? Опишите процесс осветления и обесцвечивания воды при добавлении коагулянта и флокулянта.
9.Назовите известные Вам коагулянты и флокулянты, используемые в технологиях водоподготовки.

30
РАЗДЕЛ 4.
ИССЛЕДОВАНИЕ МЕТОДА ХЛОРИРОВАНИЯ ВОДЫ
4.1. Общая часть
Хлорирование воды - постоянное мероприятие, осуществляемое на коммунальных водопроводах и станциях по обработке технических и сточных вод с целью ее обеззараживания.
При хлорировании воды в нее вводятся газообразный хлор или вещества, содержащие активный хлор (хлорная известь СaOCl2, гипохлорита натрия NaOCl, диоксида хлора СlO2, хлораминов NH2Cl и др.).
Бактерицидное действие активного хлора обусловливается главным образом присутствием в обеззараживаемой воде хлорноватистой кислоты НОCl и гипохлорит-иона ClO-, которые непосредственно взаимодействуют с веществом бактериальной клетки, разрушают фермент, усваивающий глюкозу, в результате чего происходят необратимые изменения в клетке (нарушается обмен веществ, и бактерии гибнут). Хлорноватистая кислота и продукт ее диссоциации гипохлорит-нон образуются в результате процесса гидролиза хлора и веществ, содержащих активный хлор при растворении их в воде.
Cl2 + H2O  HOCI + HCl
HOCI + HCl
CaOCl2 + 2H2O |
2HOCl + CaCl2 + Ca(ОН)2 |
Na(OCl) + H2O |
HOCl + NaOH |
Далее в нейтральной или щелочной среде HOCl диссоциирует на гипохлорит-ион и водород-ион:
HOCl  ClO- + Н+
ClO- + Н+
Хлорноватистая кислота – слабая кислота. Степень ее диссоциации зависит от температуры и рН. Наибольшим бактерицидным действием обладает недиссоциированная форма HOCl, поэтому обеззараживание будет более эффективным в условиях, когда диссоциация HOCl подавлена. Это нейтральная или слабокислая среда. В табл. 8 приведена зависимость степени диссоциации HOCl от рН воды.
|
|
|
|
|
|
|
|
|
Таблица 8. |
|
|
|
Зависимость степени диссоциации HOCl от рН воды |
|
|
||||||
рН |
4 |
|
5 |
6 |
7 |
8 |
9 |
10 |
|
11 |
ClO-, % |
0,05 |
|
0,5 |
2,5 |
21,0 |
75,0 |
97,0 |
99,5 |
|
99,9 |
HOCl,% |
99,95 |
|
99,5 |
97,5 |
79,0 |
25,0 |
3,0 |
0,5 |
|
0,1 |
Необходимая доза активного хлора для обеззараживания воды складывается из хлоропоглощаемости воды и некоторого избытка хлора (остаточного хлора), обеспечивающего в течение заданного отрезка времени бактерицидный эффект.
