
6964
.pdf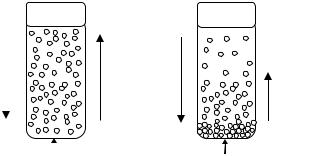
тиц. Время жизни лиофобных систем зависит от таких факторов, как степень дисперсности, величина заряда частиц дисперсной фазы, свойств дисперсионной среды.
Различают седиментационную и агрегативную устой-
чивость. Седиментационная устойчивость [седиментация лат. sedimentum оседание] – это устойчивость дисперсной системы к осаждению дисперсной фазы под действием гравитации. Агрегативная устойчивость [агрегировать лат. aggregare присоединять] – устойчивость дисперсной системы к самопроизвольному укрупнению в результате слипания или слияния частиц дисперсной фазы.
Седиментационная устойчивость
Понятие седиментационной устойчивости применимо к системам, в которых дисперсионной средой является жидкость или газ. Это свободнодисперсные системы. К ним относятся высокодисперсные системы (золи), а также средне- и грубодисперсные системы, такие, как суспензии, эмульсии, пены.
В свободнодисперсных системах частицы дисперсной фазы перемещаются по всему объему дисперсионной среды. Беспорядочное движение частиц происходит в результате соударения с молекулами дисперсионной среды, находящейся в непрерывном (тепловом) движении.
Свободное перемещение частиц по всему объему дисперсионной среды может привести к седиментации – оседанию частиц под действием гравитационного поля Земли. Всплывание частиц дисперсной фазы на поверхность дисперсионной среды (обратная седиментация) происходит в результате их вытеснения более плотной дисперсионной средой.
При седиментации гравитационным силам противодействует диффузия – процесс самопроизвольного выравнивания концентраций атомов, молекул, ионов, высоко-
дисперсных частиц под воздействием теплового движения. По мере оседания концентрация частиц дисперсной фазы в объеме становится неодинаковой. Возникает градиент концентраций (градиент концентраций от лат. gradiens шаг). Нарастает противоположный оседанию процесс диффузии, стремящийся уменьшить градиент концентраций. В результате противоположно направленных процессов седиментации и диффузии дисперсная система способна сохранять устойчивость, если скорость диффузии больше или равна скорости седиментации (рис. 29).
υсед. = υдиф |
υсед. > υдиф |
|
υсед. |
υдиф |
υсед. |
υдиф |
|
Седиментационно |
Седиментационно |
устойчивая система |
неустойчивая система |
|
|
Рис. 29. Седиментационно устойчивая и неустойчивая системы
Чем больше степень дисперсности, тем выше седиментационная устойчивость дисперсной системы. Экспериментально установлено и теоретически доказано, что частицы вещества находятся в непрерывном тепловом движении. Высокодисперсные или коллоидные системы с размером частиц дисперсной фазы 1 ÷ 100 нм (1 нм = 10−9 м) обладают ничтожно малой массой, способны при соударениях с молекулами растворителя перемещаться в любых направлениях и противостоять силам гравитации.
61 |
62 |

Средне- и грубодисперсные системы (эмульсии, пены, суспензии и др.) седиментационно неустойчивы. Они имеют ограниченный срок хранения, теряют однородность в результате оседания частиц. Так происходит потеря товарного качества масляных красок, не использованных в течение гарантированного срока хранения.
Один из способов сохранения седиментационной устойчивости состоит в перемешивании дисперсной системы. Например, цементный раствор (смесь частиц цемента и песка с водой) непрерывно перемешивают в специально оборудованной вращающейся ёмкости, перевозимой автомобилем к месту строительства.
Агрегативная устойчивость
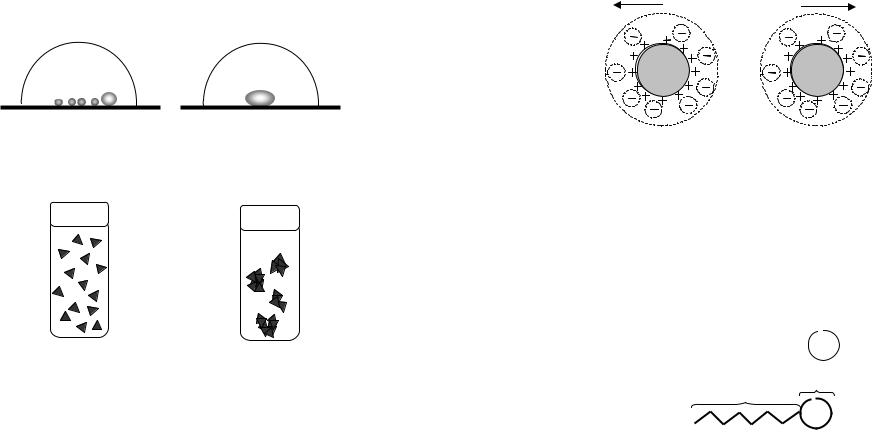
Укрупнение в результате слипания твердых частиц дисперсной фазы называют коагуляцией [коагуляция лат. coagulation свертывание, сгущение], слияние капелек жид-
кости – коалесценцией (рис. 30).
Агрегативно |
Агрегативно |
устойчивая система |
неустойчивая система |
Рис. 30. Нарушение агрегативной устойчивости в результате слияния капель нерастворимого в воде органического вещества (коалесценция)
Коалесценция происходит за счет энергии поверхностного натяжения. В результате слияния капель жидкости
сокращается площадь s поверхности раздела фаз. На рис. 31, а представлены семь шарообразных капель радиусом 0.1 мм, которые имеют следующий объем и площадь:
7 ×V = 7 × |
4 |
π × r3 |
= 7 × |
4 |
×3.14 ×(0.1)3 = 0.029 мм3 , |
|
|
||||
шар |
3 |
|
3 |
|
|
|
|
|
|||
7 × sшар = 7 × 4π × r2 = 7 × 4 ×3.14 ×(0.1)2 = 0.88 мм2 .
При слиянии в крупную каплю объем, занимаемый образовавшейся каплей, остается прежним, но площадь поверхности сокращается почти вдвое (рис. 31, б):
V = 4π r3/3 = 0.029 мм3,
r = 3 |
|
3 × 0.029 |
|
= 0.19 мм, |
||
|
||||||
s = 4π × r 2 |
4 |
×3.14 |
|
|
||
= 4 |
×3.14 ×(0.19)2 = 0.45 мм2 . |
|||||
шар |
|
|
|
|
|
|
а) |
б) |
Рис. 31. Самопроизвольное уменьшение поверхности раздела фаз, приводящее к снижению энергии поверхностного натяжения
Существует возможность объяснения укрупнения капель жидкости, связанный с различием парциальных давлений газа над поверхностью мелких и крупных капель Это можно продемонстрировать на каплях жидкости, находящихся длительное время под колпаком (рис. 32). Парциальное давление газа над поверхностью мелких капель выше парциального давления над поверхностью крупных капель, поэтому крупные капли постепенно увеличивают-
63 |
64 |
ся за счет мелких капель при диффузии молекул в газовой фазе.
Рис. 32. Укрупнение капелек ртути, находящихся в закрытом объеме
Слипание частиц приводит к нарушению агрегативной устойчивости (рис. 33).
Агрегативно |
Агрегативно |
устойчивая система |
неустойчивая система |
Рис. 33. Нарушение агрегативной устойчивости в результате слипания частичек вещества (коагуляция)
В высокодисперсных системах агрегативная устойчивость обеспечивается электростатическим отталкиванием одинаково заряженных коллоидных частиц (рис 34).
4.2. Лиофильные дисперсные системы
Представление о том, что дисперсные системы являются термодинамически неустойчивыми, изменилось, когда стали известны поверхностно-активные вещества, формирующие в водном растворе мицеллы – частицы дисперсной фазы.
Рис. 34. Модель отталкивания частиц золя в дисперсной системе
Поверхностно-активные вещества
Поверхностно-активные вещества (ПАВ) могут самопроизвольно образовывать лиофильные термодинамически устойчивые дисперсные системы. Выделяют три типа ПАВ.
Катионогенные ПАВ – органические соединения, диссоциирующие в водном растворе с образованием длинноцепочечных катионов, например:
СН3СН2(СН2)nCН2−NH3+Cl− → СН3СН2(СН2)nCН2−NH3+ + Cl−
Соль амина |
полярная |
|
|
|
группа |
|
неполярная группа |
+
Неионогенные ПАВ – органические соединения с длинной углеводородной цепью и полярной группой, не образующие в водном растворе ионов. К таким неионогенным ПАВ относятся, например, оксиэтилированные спирты:
65 |
66 |
СН3СН2(СН2)nCН2О (С2Н4О)xH
Оксиэтилированный спирт полярная
группа
неполярная группа
Широкое применение находят анионогенные ПАВ – органические соединения, диссоциирующие в водном растворе с образованием анионов, имеющих длинную углеводородную цепь:
СН3(СН2)nCН2−СОО−Na+ → СН3(СН2)nCН2−СОО− |
+ |
Na+ |
|
Соль карбоновой кислоты |
|
|
|
(мыло) |
полярная |
|
|
|
группа |
|
|
|
неполярная группа |
|
|
|
− |
|
|
СН3(СН2)nCН2–S О3−Na+ → СН3(СН2)nCН2– S О3− |
+ |
Na+ |
|
Соль алкилсульфокислоты |
|
|
|
Поверхностно-активные вещества называют дифильными соединениями, т.к. молекулы ПАВ содержат в своем составе гидрофильную (полярную) и гидрофобную (непо-
лярную) группу [гидро- др.-греч. υδωρ вода, влага; филия ϕιλια дружба, любовь; фобия ϕοβος страх].
Дифильность позволяет молекулам ПАВ взаимодействовать и с полярными и неполярными дисперсионными средами и ориентироваться на границе раздела фаз, размещая полярные и неполярные группы в соответствующих фазах.
Наиболее распространенными являются анионогенные ПАВ, входящие в состав мыла и стиральных порошков. Для получения твердого мыла используются натриевые соли пальмитиновой (пальмитат натрия С15Н31СООNa), стеариновой (стеарат натрия С17Н35СООNa) и олеиновой кислот (олеат натрия С17Н33СООNa). Жидкое мыло является калиевым производным, например, стеарат калия С17Н35СООК.
Соли высокомолекулярных карбоновых кислот отличаются небольшой растворимостью в воде. Растворимость мыла уменьшается с увеличением кислотности среды, а в жесткой воде (содержащей ионы Ca2+ и Mg2+) образуются труднорастворимые соли магния и кальция, которые осаждаются на поверхности стираемых изделий.
Анионогенные соли сульфокислот кислот лишены этих недостатков. Они хорошо растворимы в воде и не выпадают в осадок даже в жесткой воде.
Отступление. Примерно половина производимых промышленностью ПАВ используется для получения моющих и чистящих средств.
Алкилсульфонаты СН3(СН2)nCH2SO3Na, содержащие 12 – 14 углеродных атомов в углеводородной цепи, используются в шампунях.
В стиральных порошках используются алкилбензолсульфонаты СН3(СН2)nC6H4SO3Na в композиции с солями угольной (NaHCO3, Na2CO3) и серной кислот (Na2SO4), ароматизаторами и флокулянтами [лат. flocculi хлопья]. Последние представляют собой полимерные соединения, которые при растворении в воде образуют рыхлые хлопья. Они захватывают частицы грязи в составе мицелл и не дают им осесть на поверхности отстиранных тканей.
При вращательном бурении газовых и нефтяных скважин используются буровые насосы, предназначенные для прокачивания воды и глинистых растворов, обеспечивающих циркуляцию промывочной жидкости в скважине. Для регулирования агрегативной устойчивости глинистых растворов, поступающих в скважину, применяют добавки высокомолекулярных ПАВ – водорастворимых эфиров целлюлозы, а также кальциевых солей природных и жирных синтетических кислот и алкилароматических сульфонатов.
67 |
68 |
В эмульсионной полимеризации (получение полистирола и других виниловых полимеров) используются добавки солей синтетических жирных кислот СН3(СН)nCH2COONa и алкилсульфонатов СН3(СН)nCH2SO3Na.
При механической обработке металлов и повышении скорости резания, строгания, фрезерования также используются водные растворы мыла.
Необходимо выделить три основных свойства ПАВ:
1.способность понижать поверхностное натяжение на границе раздела фаз;
2.способность к самопроизвольному образованию мицелл;
3.способность к растворению веществ внутри мицел-
лы (солюбилизация).
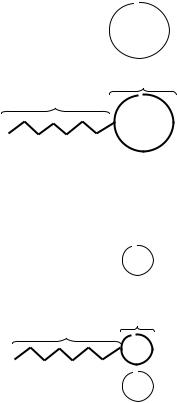
Гомогенный раствор ПАВ может перейти в состояние высокодисперсной системы. Такое свойство появляется, когда длина углеводородной цепи ПАВ насчитывает 10 и более атомов углерода. В поверхностном слое ПАВ адсорбируется, располагаясь неполярной углеводородной группой в газовой фазе, а полярной – в водном растворе, при этом существенно снижается поверхностное натяжение
(рис. 35).
В растворе кроме одиночных молекул ПАВ самопроизвольно происходит формирование сферических агрегатов – мицелл, содержащих десятки молекул ПАВ.
Мицелла − это ассоциат дифильных молекул ПАВ, лиофильные группы которых обращены в сторону растворителя, а лиофобные объединяются друг с другом в центре, образуя ядро (рис. 35).
В водных мицеллярных системах ПАВ солюбилизируются вещества, не растворимые в воде, такие, как жир, углеводороды, бензол и т.п. Это связано с тем, что ядро мицеллы проявляет свойства неполярной жидкости и туда внедряются неполярные вещества. Этот процесс называет-
ся солюбилизацией.
Рис. 35. Адсорбция ПАВ на границе вода – воздух и образование мицеллярного раствора
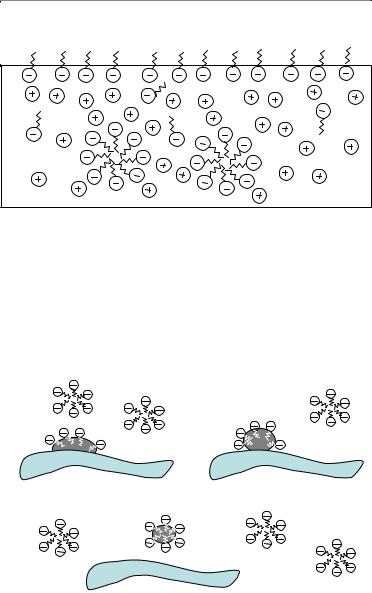
Вышеуказанные свойства ПАВ используются при очистке поверхностей от масляных пятен (рис. 36). Молекулы мыла концентрируются на поверхности раздела фаз вода – масло (рис. 36, а), причем неполярные углеводородные цепи ПАВ обращены в сторону жирного пятна.
ткань
а) |
б) |
|
|
|
Мыльная вода |
в)
Рис. 36. Модель очистки ткани от жирных пятен (стирка)
69 |
70 |

По мере интенсивного движения ткани в стиральной машине или при ручной стирке происходит солюбилизация жира мицеллами ПАВ (рис. 36, б), и весь жир уходит с поверхности ткани в мыльный раствор (рис. 36, в). Без ПАВ жирное пятно осталось бы на поверхности ткани, так как органические вещества не растворимы или плохо растворимы в воде.
Высокомолекулярные соединения
Высокомолекулярные соединения (ВМС) или полимеры
представляют собой кристаллические или аморфные вещества, макромолекулы которых построены из тысяч атомов, соединенных химическими связями в длинные цепи. Повторяющийся фрагмент полимерной цепи макромолекулы называют мономерным звеном. Длину макромолекул выражают средним числом звеньев мономера в полимере (n),
которое называют степенью полимеризации.
В зависимости от структуры молекулярной цепи полимера, степени полимеризации, а также от свойств растворителя ВМС могут растворяться с образованием истинного раствора, набухать или не растворяться. Например, полиметилметакрилат растворяется в хлороформе, каучук набухает, а эбонит вообще не растворяется в органических растворителях.
Несмотря на то, что при растворении полимеры часто образуют истинные растворы, они являются предметом исследования коллоидной химии по двум причинам. Вопервых, длина полимерных цепей макромолекул сопоставима с размерами частиц дисперсной фазы. Во-вторых, макромолекулы ВМС при растворении в некоторых растворителях способны свертываться в клубки, образуя частицы дисперсной фазы. В последнем случае растворение полимера приводит к образованию гетерогенной системы с присущими ей свойствами.
Синтетические полимерные материалы, как свидетельствует название, получают в результате химических реакций синтеза макромолекул из мономеров. Полиэтилен, полиэтилентерефталат (тефлон), полиметилметакрилат (рис. 37) и другие полимерные материалы − это синтетические высокомолекулярные соединения.
Мономерное звено полимерной цепи
O |
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
CH2 |
O |
|
|
C |
|
|
|
|
|
C |
|
|
||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
n |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
полиэтилентерефталат |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
[ |
CH2 |
|
|
|
|
CH2 ] n |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
полиэтилен |
|
|
|
|
|
|
|||||||||||
CH3
O
C=O
CH2 C
CH3 n
Полиметилметакрилат
Рис. 37. Структура молекул некоторых синтетических полимеров, n − степень полимеризации
Природные (натуральные) полимерные вещества синтезируются живыми организмами (растениями, животными, микробами). К ним относятся белки, полисахариды (крахмал, целлюлоза) и нуклеиновые кислоты.
Крахмал и целлюлоза – высокомолекулярные природные полимеры, построенные из остатков глюкозы (рис. 38).
Белки – высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных пептидной связью – СО–NH – ( рис. 38).
71 |
72 |

|
|
|
|
|
|
Пептидная |
Аминокислотный |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
группа |
|
|
|
|
|
|
остаток |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
H |
|
O |
|
R |
|
|
|
|
H |
|
|
O |
|
|
|
R |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
R |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
N |
|
|
|
C |
C |
|
|
|
N |
|
|
C |
|
|
|
C |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
C |
|
|
|
|
N |
|
|
|
C |
C |
N |
H |
C |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
R |
|
|
|
|
H |
|
|
O |
R |
H |
|
|
O |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Белок |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
O H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
O |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
n = 200 - 1000 |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
Фрагмент молекулы крахмала (амилоза) |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
CH2OH |
|
|
|
|
|
|
|
|
CH2OH |
|
|
|
|
|
|
|
|
|
|
CH OH |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
H |
|
O |
|
|
H |
|
|
|
|
|
O |
|
|
|
|
|
|
H |
|
2 |
O |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
H |
|
|
O |
|
|
|
H |
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||||||||||||||||
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
H |
H |
O |
|||||||||||||||||||||
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|||||||
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
H |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Целлюлоза |
|
|
|
|
|
|
n = 3000 - 14000 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Рис. 38. Структура молекул некоторых природных полимеров: белка, крахмала и целлюлозы, R в белках – углеводородный радикал
Молярная масса белка может колебаться от 10000 до 1 000 000 г/моль, т.е. от 104 до 106 а.е.м. Например, гемоглобин крови состоит из 574 аминокислотных остатков, соединенных пептидными связями, и имеет молярную массу, равную 64500 г/моль. Составными частями кожи, сухожилий, миозина, входящего в состав мышц, являются белки. Некоторые белки характеризуются специфической формой
свернутой полипептидной цепи. К ним относятся белки, входящие в состав крови, лимфы, протоплазма клеток, пепсин желудочного сока.
Белки относятся к группе полиэлектролитов. Для них характерно явление электрофореза – движение макромолекул белка в водной среде под действием электрического поля. Белок – биполярный ион, электролитическая диссоциация которого зависит от кислотности (рН) водного раствора:
+ |
|
R |
|
H |
O |
|
R |
H |
O |
_ |
|
R |
H |
|
O |
|
||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
+ |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|||||||
H3N |
|
C |
|
C |
|
|
H |
|
H3N+ |
|
C |
|
C |
_ |
|
|
|
H N |
|
C |
|
|
C |
_ |
+ H O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
C |
|
N |
OH |
C |
N |
O |
2 |
C |
|
|
|
2 |
|||||||||||||
|
|
|
|
|
|
N |
|
O |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
H n |
|
|
|
|
|
O |
H n |
|
|
|
|
|
O |
H |
n |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
В кислой среде (рН<7) |
|
|
|
|
|
|
|
В щелочной среде (рН>7) |
||||||||||||||||||
При помощи рН среды можно изменять ионизирующую способность макромолекул белков. Константы диссоциации кислотных и основных групп в белках и аминокислотах не совпадают. По этой причине число диссоциированных кислотных и основных групп может быть одним и тем же только при определенном значении рН среды. Такое состояние соответствует изоэлектрической точке (ИЭТ) – условию, когда ζ = 0.
Специфичность отношения синтетических или природных полимеров к растворителю состоит в том, что не всякий растворитель является подходящей средой для растворения ВМС. Полярные полимеры набухают и растворяются в полярных, а неполярные – в неполярных растворителях.
Растворению полимера предшествует набухание – проникновение молекул органического растворителя в массу полимера. Растворитель, накапливаясь в полимере, увеличивает подвижность макромолекул и уменьшает межмолекулярное взаимодействие. Если полимер сшитый (имеет нерастворимый химически связанный каркас), то при его
73 |
74 |
набухании образуется гель – дисперсная система, содержащая растворитель в полимерном каркасе.
Гель – [ лат. gelo застываю] дисперсная система с жидкой дисперсионной средой, в которой частицы дисперсной фазы образуют пространственную структурную сетку. Это твердообразные «студенистые» тела, способные сохранять форму, обладающие упругостью и пластичностью. В коллоидной химии гели часто образуются при коагуляции золей за счет межмолекулярного взаимодействия частиц золя.
Если полимер имеет каркас, образованный слабыми межмолекулярными связями (водородными и силами Ван дер Ваальса), то при набухании каркас постепенно разрушается, и образуются два раствора. Более концентрированная фаза представляет собой каркас, содержащий слои жидкости с низкой концентрацией молекул полимера.
Явление набухания полимера и превращение его в гель используется для так называемой пластиозольной технологии получения покрытий и пленок.
Краткий итог темы
1.Лиофобные дисперсные системы являются термодинамически неустойчивыми. Стабильность лиофобных систем можно повысить, повышая агрегативную и седиментационную устойчивость.
2.Агрегативную устойчивость поддерживают электростатические силы отталкивания (обусловленные наличием дзета-потенциала), которые препятствуют слипанию частиц дисперсной фазы. Им противостоят силы межмолекулярного притяжения (ван-дер-ваальсовые силы), вызывающие коагуляцию.
3.Седиментационная устойчивость (устойчивость к оседанию) повышается при дроблении частиц дисперсной фазы. Высокую седиментационную устойчивость прояв-
ляют высокодисперсные коллоидные растворы (золи). Небольшой размер частиц золя обеспечивает равномерное распределение их по всему объему дисперсной среды за счет диффузии.
4.Лиофильные дисперсные системы являются термодинамически устойчивыми. К лиофильным дисперсным системам относятся растворы поверхностно-активных веществ (катионогенные, анионогенные и неионогенные).
5.Необходимо выделить три основных свойства по- верхностно-активных веществ: способность понижать поверхностное натяжение на границе раздела фаз, способность к самопроизвольному мицеллообразованию и солюбилизации.
6.Дифильность молекул ПАВ позволяет им взаимодействовать как с полярными, так и неполярными дисперсионными средами и ориентироваться на границе раздела фаз, размещая полярные и неполярные группы в соответствующих фазах.
7.Истинные растворы синтетических и природных полимеров рассматриваются в коллоидной химии потому, что молекулы полимера по линейным размерам сопоставимы с размерами частиц высокодисперсной фазы, а также
врастворах полимеров при определенных условиях возможно формирование клубков молекул ВМС – частиц дисперсной фазы.
8.Растворению полимера предшествует набухание – проникновение молекул органического растворителя в массу полимера. Если полимер имеет каркас, образованный слабыми межмолекулярными связями (водородными связями или силами Ван дер Ваальса), то при набухании каркас постепенно разрушается, и образуются два раствора. Более концентрированная фаза представляет собой каркас, содержащий слои жидкости с низкой концентрацией молекул полимера.
75 |
76 |
Явление набухания полимера и превращение его в гель используется для так называемой пластиозольной технологии получения покрытий и пленок.
Термины для запоминания
Агрегативная устойчивость – это стабильность дис-
персной системы к самопроизвольному укрупнению в результате слипания или слияния частиц дисперсной фазы.
Анионогенные ПАВ – органические соединения, содержащие полярную группу и диссоциирующие в водном растворе с образованием длинноцепочечных анионов.
Белки – высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных пептидной связью – СО–NH –
Высокомолекулярные соединения (полимеры) – кри-
сталлические или аморфные вещества, молекулы которых построены из тысяч атомов, соединенных химическими связями в длинные цепи.
Гель – дисперсная система с жидкой дисперсионной средой, в которой частицы дисперсной фазы образуют пространственную структурную сетку.
Диффузия – процесс самопроизвольного выравнивания концентраций атомов, молекул, ионов, высокодисперсных частиц под воздействием теплового движения.
Катионогенные ПАВ – органические соединения, содержащие полярную группу и диссоциирующие в водном растворе с образованием длинноцепочечных катионов.
Коагуляция – укрупнение в результате слипания твердых частиц дисперсной фазы.
Коалесценция – слияние капелек жидкости при взаимном контакте.
Мицелла ПАВ − это ассоциат дифильных молекул ПАВ, лиофильные группы которых обращены в сторону
растворителя, а лиофобные объединяются друг с другом в центре, образуя ядро.
Набухание – проникновение молекул органического растворителя в массу полимера.
Неионогенные ПАВ – длинноцепочечные органические соединения, содержащие полярную группу, в водном растворе не распадающиеся на ионы.
Обратная седиментация – всплывание частиц дис-
персной фазы на поверхность в результате их вытеснения более плотной дисперсионной средой.
Седиментационная устойчивость – это устойчи-
вость дисперсной системы к осаждению дисперсной фазы под действием гравитации.
Солюбилизация – это явление растворения веществ в мицеллах ПАВ.
Вопросы для проверки знаний
1.Существуют ли термодинамически устойчивые дисперсные
системы?
2.Достаточно ли только седиментационной или только агрегативной устойчивости, чтобы дисперсная система была устойчива?
Упражнения
1.Известно, что электростатическое отталкивание частиц дисперсной фазы, окруженной двойным электрическим слоем тем выше, чем больше дзета-потенциал. Объясните характер изменения двойного электрического слоя, приводящий к коагуляции при добавлении в раствор сильного электролита.
2.Чем объяснить, что мицеллообразование ПАВ является самопроизвольным процессом?
3.Имеем истинный раствор ПАВ в воде. Объясните, какие процессы будут проходить в коллоидном растворе при увеличении концентрации ПАВ?
77 |
78 |
ТЕМА 5 ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ И ДИСПЕРСНЫХ СИСТЕМ
Планета Земля, её атмосфера, гидросфера, литосфера, биосфера – гигантские по своим масштабам дисперсные системы. Растения, животные (включая человека), микробы – сложнейшие коллоидные системы. Строительные материалы, медицинские препараты, продукты питания в значительной степени представлены дисперсными системами.
В технологических процессах используют поверхностные явления и дисперсные системы: катализаторы, адсорбенты, эмульсии и суспензии в полимеризации. Промышленное производство муки, крахмала, паст, кремов, мыла, стирального порошка, лекарственных препаратов и других дисперсных материалов осуществляется в громадных масштабах.
Широко используются коагуляционные структуры. К ним относятся гели – структурированные твердообразные дисперсные системы, в каркасе которых содержится жидкая дисперсионная среда. Высушенный гель, из которого удалена дисперсионная среда, переходит в состояние ксерогеля. Уголь, торф, картон, древесина, бумага, ткани, кожа, глина и многие другие материалы относятся к гелям или ксерогелям.
Конденсационно-кристаллизационные структуры образуются в результате химического взаимодействия частиц дисперсной фазы. Твердение воздушных и гидравлических вяжущих веществ завершается кристаллизационным структурообразованием. Например, смешение порошка строительного гипса с водой вызывает формирование на
воздухе гидратированной ионной кристаллической структуры CaSO4×2H2O(т) в результате реакции:
CaSO4×0.5H2O(т) + 1.5H2O(ж) ® CaSO4×2H2O(т).
Кристаллическая структура бетона формируется при замешивании цемента с песком и водой.
Ниже будут рассмотрены микрогетерогенные дисперсные системы: аэрозоли, порошки, суспензии, эмульсии, пены, сплавы и композиционные материалы, свойства которых широко используются в практической деятельности человека.
5.1. Получение дисперсных систем
Природные дисперсные системы, такие, как пыль, дым, туман, донный ил, мутная вода, снег, кварцевый песок, образуются в результате испарения, трения, конденсации и других физико-химических процессов, происходящих на планете.
Искусственные дисперсные системы получают двумя путями: диспергационным методом – измельчением твердых и жидких тел в дисперсионной среде и конденсационным методом – образованием в гомогенной среде новой фазы.
Диспергационные методы
Диспергационные методы – способы дробления вещества для получения высоко-, средне- и грубодисперсных систем. Они включают механическое, ультразвуковое и электрическое дробление. Механическое диспергирование
осуществляется в дробилках и мельницах путем истирания, удара, дробления или комбинации этих действий (рис. 39,
а). Ультразвуковое диспергирование происходит при воз-
действии ультразвуковых колебаний на смесь нерастворимых друг в друге жидкостей или смеси твердого тела с жидкостью. При прохождении ультразвуковой волны в смеси веществ возникают местные, быстро чередующиеся
79 |
80 |
