
2966
.pdf11
Лабораторная работа № 5
Методы микробиологического исследования воды
Пояснения. Микробиологические исследования воды проводятся в следующих случаях: при выборе источника водоснабжения, при систематическом санитарном контроле, по эпидемическим показаниям.
Исследованию подлежат следующие воды: 1. вода централизованного водоснабжения, 2. колодезная вода, 3. вода плавательных бассейнов, 4. сточные воды; Исследования вод централизованного водоснабжения проводятся по стандартным методикам, изложенным в ГОСТ 18963-73. При неблагоприятной санитарно-эпидемиологической обстановке (коли-индекс более 10000) проводят дополнительные исследования воды: на наличие патогенных кишечных, бактерий (сальмонеллы и нигеллы), энтеровирусов, показателей свежего фекального загрязнения (фекальные кишечные палочки, энтерококки, фаги БГКП).
Согласно требованиям ГОСТ 18963-73, определяют содержание в 1 мл исследуемой воды мезофильных аэробов и факультативных анаэробов, способных образовывать за 24 часа при 37° С колонии, видимые при увеличении в 2-5 раз.
Термины и определения: Микробное число - количество сапрофитных бактерий в I мл исследуемой воды, выявляемое путем посева на стандартную питательную среду (например, МПА). КОЕ « колониеобразующая единица (1 бактерия, образующая колонию).
Колония бактерий - совокупность бактерий, развившаяся из 1 клетки и видимая невооруженным глазом.
Цель работы: познакомиться с методом определения общего микробного числа в водной среде обитания.
Материалы и оборудование: стерильные чашки Петри, микробиологическая петля, МПА в пробирках, спиртовка, термостат, микроскоп, электроплитка, вода из открытого водоема.
Ход работы.
Порядок отбора проб воды для анализа
1.Водопроводный кран протирают тампоном, смоченным спиртом и обжигают.
2.Спускают воду из крана в течение 10-15 минут.
3.В стерильную посуду отбирают около 400 мл воды.
Заполненные флаконы закрывают стерильными ватными пробками и сверху надевают бумажные колпачки. При анализе хлорированной воды вносят вещество дехлоратор - гипосульфит натрия в количестве 10 мг на 500 мл воды. Бактериологическое исследование отобранных проб воды проводится не позднее, чем через 2 часа с момента отбора пробы, в крайнем случае, не позднее 6 часов при условии хранения пробы в холодильнике при 1-5° С.
Также помимо водопроводной воды рекомендуется отобрать талую воду и воду из наземных источников (луж, ручьёв).
Посев пробы воды для анализа
Из пробы делают посев не менее 2 различных объемов воды, причем объем воды выбирают с таким расчетом, чтобы число колоний на чашках Петри колебалось бы в пределах 30-300.
Выбор объема воды для посева: Водопроводная вода - 1 мл Чистые воды - 0,1-1 мл
Более загрязненные воды - 0,01-0,001 мл
12
Сточные воды - 0,0001-0,00001 мл Для посева 0,1 мл и меньших объемов воды исследуемую воду разводят стерильной
дистиллированной водой (готовят последовательные десятикратные разведения - для каждого разведения берется отдельная стерильная пипетка). Если вода заведомо чистая, то производят посев неразбавленной воды.
Пробы воды объемом 1 мл из каждого разведения вносят в 2 чашки Пети (и заливают слоем растопленного и остуженного до 45° С агара. Затем посевы выращивают в термостате в течение суток при 37°C. Результаты учитывают только на тех чашках, где число колоний колеблется от 30 до 300. Производят перерасчет содержания бактерий на 1 мл воды. Результаты подсчета числа колоний округляются следующим образом:
1-100 без округления;
101-1000 результат округляют до десятков;
1001-10000 результат округляют до сотен;
10001-100000 результат округляют до тысяч;
10001-1000000 результат округляют до десятков тысяч За окончательный результат принимают среднее арифметическое подсчета 2 параллельных
измерений.
Метод счета колоний
Счет колоний производится лупой с 2-5 кратным увеличением. Если на чашке Петри много колоний, то подсчет производится с помощью камеры Вольфгюгеля (стекло камеры разделено на квадраты, площадью I см каждый).
Чашку с колониями переворачивают вверх дном и ставят на подставку. Чашку накрывают стеклом с квадратами и подсчитывают число колоний, расположенных в 20 квадратах в различных местах чашки. Вычисляют среднее арифметическое число колоний на 1 см. Полученное среднее арифметическое умножают на площадь чашки. Пересчитывают число колоний на I мл воды.
Данные занести в таблицу, вид под микроскопом зарисовать.
В выводе рекомендуется написать пробу воды с наибольшим количеством микроорганизмов и обосновать такие результаты.
Таблица 5.1 Число КОЕ, полученное при посеве проб воды
Проба |
Кратность |
|
Число КОЕ в чашках Петри |
||
разведения |
№ 1 |
|
№ 2 |
Среднее значение |
|
|
|
||||
Дистиллированная вода |
|
|
|
|
|
Талая вода |
|
|
|
|
|
Вода из лужи |
|
|
|
|
|
Лабораторная работа №6
Микробиологическое исследование почвы
Пояснения. Санитарно-микробиологическое исследование почвы проводят в следующих целях: для подробной характеристики санитарного состояния почвы; при определении пригодности участка для жилищного строительства; при контроле за работой очистных сооружений; при эпидемиологических исследованиях.
При проведении текущего санитарного надзора определяют: содержание бактерий группы кишечной палочки; общее число сапрофитных бактерий.
Цель работы: познакомиться с методами микробиологического исследования почвы.
13
Материалы и оборудование: пробирки, микробиологическая петля, спиртовка, ступка, стерильная вода в пробирках и колбах, весы с разновесом, чашки Петри, стеклянные шпатели, пинцеты, электрическая плитка, термостат.
Ход работы.
Отбор проб почвы
При выборе места взятия проб необходимы следующие данные: топографические данные местности; описание почвенного и растительного покрова; данные, характеризующие климат местности; размеры обследуемой территории; сведения о наличии или отсутствии канализаций; расстояния от источников загрязнения воды и почвы.
На обследуемой территории площадью до 1000 м выделяют 2 участка площадью по 25 м (один участок выбирают вблизи источников загрязнения, другой - вдали от них). С каждого участка составляют средний образец из отдельных проб. При изучении бактериального загрязнения поверхностных слоев почвы для анализа берут слой почвы глубиной до 20 см. Из отдельных точек участка выкапывают навеску почвы массой 200-300 граммов, переносят навеску в стерильную посуду и перемешивают. Инструменты, применяемые для работы перед взятием проб на участке, следует обмыть, обтереть ватным тампоном, смоченным спиртом, и затем обжечь. Пробы; взятые для анализа, переносят в стерильную банку с ватно-марлевой пробкой, и покрывают стерильной бумагой. Пробы этикетируют.
Приступать к анализу необходимо как можно быстрее с момента отбора пробы. Допускается хранение проб в холодильнике при 1 -2° С не более 24 часов.
Образца почвы освобождают от крупных включений. Почвенные микроорганизмы находятся в адсорбированном состоянии на коллоидах почвы.
Поэтому для анализа микрофлоры почвы необходимо диспергировать пробу в стерильной воде. Навеску почвы массой около 30 граммов высыпают в стерильную чашку с полированной поверхностью, растирают с 10-15 мл стерильной водопроводной воды в течение 5 минут. Оставшуюся на чашке почву смывают в колбу. Из полученной суспензии готовят без отстаивания последовательные разведения. Первоначально готовят разведение 1:10. Затем из этого разведения последовательно готовят разведения 1:1000,1:10000, При анализе сильно загрязненных почв используют разведение до 1:1000000.
Из каждой пробы почвы используют для посева не менее 2 различных разведений. Перед посевом суспензию в каждой пробирке тщательно перемешивают стерильной пипеткой. Затем из пробирки отбирают стерильной пипеткой 1 мл суспензии и переносят на дно стерильной чашки Петри (каждое разведение вносят минимум на 2 чашки).
Затем вливают в чашку 10 мл растопленного и остуженного до 45° С агара.
Расплавленный агар тщательно перемешивают с почвенной суспензией. Выращивание микроорганизмов проводят в течение 24 часов при температуре 2830° С. Если выращивание проводят при 22° С, то срок инкубации увеличивают до 72 часов. После инкубации подсчитывают количество выросших колоний (по методу счета колоний).
Для подсчета берут такие разведения, при которых на чашках вырастает от 50 до 150 колоний. Из суммы колоний, выросших на 2 чашках, выводят среднее арифметическое и пересчитывают число колоний на Г грамм почвы. Число сапрофитных бактерий - в почве используется только в комплексе с другими санитарно-микробиологическими показателями.
При санитарной оценке почвы определяют не только типичные кишечные палочки, но и все разновидности бактерии группы кишечной палочки, сбраживающие глюкозу и Лактозу и не обладающие оксидазной активностью. Определение БГКП в почве возможно путем прямого поверхностного посева почвенной суспензии на питательную среду.
Ход определения содержания микроорганизмов в почве
14
Готовят среду Эндо. Среду Эндо разливают в чашки Петри, подсушивают в сушильном шкафу. Готовят почвенную суспензию. При работе с сильно загрязненными почвами используют разведение до 1:1000000.
Стерильной пипеткой берут 0,1-0,5 мл почвенной суспензии, делают посев на среду Эндо. Посевы выращивают на среде Эндо в течение 24 часов при 37° С. Затем производят подсчет колоний. Результат анализа может быть выражен коли-титром или колн-нндексом.
Результаты занести в таблицу. В выводе рекомендуется указать, какая почва более богата микроорганизмами и чем это вызвано.
Таблица 6.1 Сводная таблица результатов микробиологических исследований почвы
|
|
Разведение |
|
||
Название, горизонт |
|
Среднее |
|
Среднее |
|
1:10 |
арифметическ |
1:100 |
арифметическо |
||
|
|||||
|
|
ое |
|
е |
|
Лабораторная работа № 7
Бактериологические исследования атмосферного воздуха
Пояснения. Микробиологические исследования воздуха проводятся седиментационными и аспирационными методами. В Основу седиментационных методов положено
оседание (седиментация) микроорганизмов из воздуха на чашку с питательной средой под действием силы тяжести. Аспирационные методы основаны на прокачивании определенного объема исследуемого воздуха через стерильный поглотительный раствор.
При помощи седиментационных методов возможно получить лишь общее представление о видовом составе встречающихся в воздухе микроорганизмов. Аспирационные методы дают возможность количественно определить содержание микроорганизмов в определенном объеме воздуха.
При посеве на среды следует стремиться к тому, чтобы число выросших колоний не превышало бы 200-300 на чашке. Определение патогенных и условно-патогенных микроорганизмов в воздухе проводят на специальных дифференциально-диагностических средах.
Цель работы: познакомиться с методом бактериологического исследования Атмосферного воздуха.
Материалы и оборудование: пробирка, микробиологическая петля, спиртовка, (стерильная вода в пробирках, МПА в пробирках. пинцеты» электрическая плитка, термостат.
Ход работы: Метод оседания
Метод оседания основан на оседании бактериальных частиц и капель под влиянием силы тяжести на поверхность агара открытой чашки Петри.
Пробы атмосферного воздуха отбираются в зоне дыхания человека на высоте 1,5 м. В ходе исследований используется метод Коха, основанный на самопроизвольной
седиментации из неограниченного пространства, и позволяющий установить факт наличия микробов в воздухе. Для расчета используется формула Омелянского, которая позволяет количественно оценить обсеменённость:
x = |
п×100 |
×100 |
(7.1) |
|
75,5
15
где
x – количество м.о. в I куб.м.
п – количество колоний на чашке, 75,5 кв.см. – площадь питательной среды
Пробы “ засеваются" седиментационным методом на чашки Петри с питательными средами: МПА - для учета общего числа сапрофитных бактерий в 1 куб. м., атмосферного воздуха; среда Сабуро - для учета плесневых грибов, дрожжей, бацилл; желточный агар - для учета кокковых форм.
Согласно ГОСТ 12.1.016-79 предельно-допустимые концентрации бактерий в I куб.м воздуха промышленного города составляют 5.000 клеток.
Таблица 7.1 Допустимые санитарно-бактериологические показатели для атмосферного воздуха и воздуха закрытых помещений
Исследуемые пробы |
Микробное число |
Содержание бактерий в 1 куб. м |
||
|
|
|
Str.haemolynicus |
Staph. aureus |
Воздух зел.зоны |
до 350 |
- |
- |
|
Воздух |
жилых |
|
|
|
невентилируемых |
|
|
|
|
помещений |
|
|
|
|
летом |
|
до 1500 |
до 16 |
|
зимой |
|
до 4500 |
до 36 |
|
|
|
|
|
|
Воздух |
больничных |
|
|
|
палат |
|
|
|
|
летом |
|
до 3500 |
до 16 |
до 24 |
зимой |
|
до 5000 |
до 32 |
до 52 |
|
|
|
|
|
Рекомендуется производить исследования в здании ННГАСУ. Данные занести в таблицу. При расчёте использовать формулу 7.1.
В выводе следует указать, соответствуют ли санитарно - бактериологические показатели атмосферного воздуха нормам. Также указать максимальное и минимальное количество колоний на этажах, обосновать полученные результаты.
Таблица 7.2 Сводная таблица бактериологического исследования воздуха в зданиях ННГАСУ
Этаж |
Количество м. о. в 1м3 |
КОЕ |
1 |
|
|
2 |
|
|
3 |
|
|
Лабораторная работа № 8

16
Метод стекло обрастания по Н.Г.Холодному (анализ природной ассоциации почвенных микроорганизмов)
Цель работы: Ознакомится с методом стекла обрастания, изучить состав и распределение микроорганизмов в их природной ассоциации.
Материалы и оборудование: Предметное стекло, спиртовка, краситель (KMnO4), микроскоп.
Ход работы: Делают почвенный разрез на необходимую глубину. Одна из стенок разреза делается гладкой. Чистое, стерильное, обезжиренное предметное стекло плотно прикладывают к стенке разреза к прикапывают. Через 3-4 недели стекло откапывают и осторожно отделяют от стенки, к которой оно было прижато. За это время с почвенным раствором на стекло попадают различные микроорганизмы, которые начинают размножаться и со временем образуют микробоценозы, характерные для данной почвы и в данное время.
Стекла подсушивают на воздухе и фиксируют на пламени горелки. Крупные части мы почвы после фиксации препарата осторожно отмывают водой. Затем препарат окрашивают фуксином, эритрозином или другими красителями, высушивают и микроскопируют.
Метод позволяет увидеть под микроскопом состав и распределение микроорганизмов в их природной ассоциации.
Образцы зарисовать. В выводе рекомендуется написать, какие микроорганизмы удалось установить на образцах. На каком образце развитие организмов более активно, чем это объясняется.
Лабораторная работа № 9
Анализ взаимоотношения микроорганизмов
Цель работы: Определить, каким образом культуры взаимодействуют друг с другом
Материалы и оборудование: Препаровальные иглы, скальпель, капельница с дистиллированной водой, чашка Петри, покровные и предметные стёкла.
Ход работы: Грибы, лишайники или плесень высеваются напротив друг друга на агар-солодовой среде в чашки Петри (допускаются другие комбинации, например: гриб, напротив лишайника и т.д.). Выращивание происходит при температуре 20 оС в течении минимум 7 дней.
Образцы будут взаимодействовать друг с другом различным способом, в зависимости от того, для какого образа условия наиболее близки к оптимуму.
Высеянные образцы могут реагировать друг с другом следующими способами: один образец полностью или частично перерос другой, который прекращает свой рост; образцы взаимно прорастают друг под друга, не препятствуя росту; рост обоих образцов прекращается при контакте (образуется зона ингибиции); один образец подрастает под другой, который прекратил свой рост, и т.д.
Таблица 9.1 Способы взаимоотношения образцов
Образец №1 |
Образец №2 |
Образец №3 |
Образец №4 |
Образец №1
Образец №2
Образец №3
Образец №4
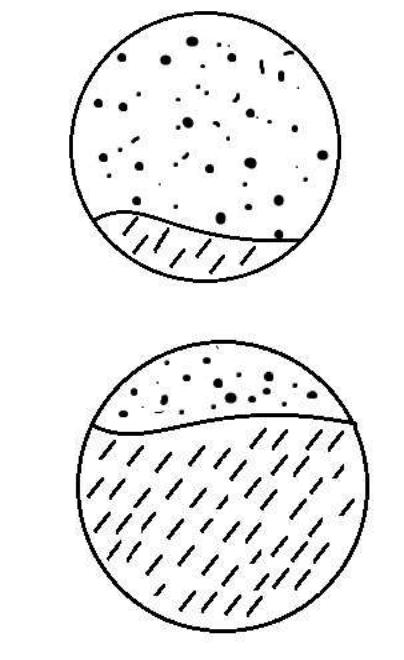
17
Образцы зарисовать. Результаты занести в таблицу 9.1, в которой рекомендуется применить следующее обозначение: ПГмикроорганизм по горизонтали перерастает микроорганизм по вертикали; ПВ – обратная тенденция; ПГ,ПВ – оба микроорганизма сосуществуют, не препятствуя росту друг друга; ЗИ - рост микроорганизмов при контакте прекращается (образуется зона ингибиции); ПГНмикроорганизм по горизонтали нарастает на микроорганизм по вертикали; ПВНобратная тенденция.
Рис 9.1 Перерастание одного микроорганизма другим
Рисунок 9.2 Гармоничное сосуществование микроорганизмов

18
Рис 9.3 Образование зоны ингибиции
Рис 9.4 Нарастание одного микроорганизма на другой

19

20
Литература.
1.Микробиология [Текст] : методическое указание для студентов по специальности 511100 – «Экология и природопользование» / Нижегор. гос. архит. – строит. ун-т, каф. экологии и природопользования ; сост. В. П. Гаврилов, Д. Н. Федорвский, Ю.А. Сизов – Н. Новгород : Изд-во ННГАСУ, 1997. – 25 с.
2.Шевченко С.В. Цилюрик А.В. Лесная фитопатология учебник[Текст] / Шевченко С.В. Цилюрик А.В. : Киев, головное издательство, 1986. – 384 с.
3.Рипачек В. Биология дереворазрушающих грибов[Текст]: Лесн. пром-сть, 1967 – 276 с.
