
2615
.pdf
11
В реакциях символом [K] обозначена нерастворимая матрица полимера катионита, условно принимаемая за анион кислотного остатка одноосновной кислоты.
При регенерации катионита раствором кислоты (соляной HCl или серной H2SO4) он переводится Н-форму. При использовании такого катионита
умягчение воды протекает по следующим реакциям:
2[K]H + Ca(HCO3)2  [K]2Ca + 2CO2 + 2H2O 2[K]H + Mg(HCO3)2
[K]2Ca + 2CO2 + 2H2O 2[K]H + Mg(HCO3)2  [K]2Mg + 2CO2 + 2H2O
[K]2Mg + 2CO2 + 2H2O
2[K]H + CaCl2 [K]2Ca + 2HCl 2[K]H + MgCl2
[K]2Ca + 2HCl 2[K]H + MgCl2  [K]2Mg + 2HCl
[K]2Mg + 2HCl
2[K]H + CaSO4  [K]2Ca + H2SO4 2[K]H + MgSO4
[K]2Ca + H2SO4 2[K]H + MgSO4  [K]2Mg + H2SO4
[K]2Mg + H2SO4
Катионитовый способ умягчения применяется при исходной общей жесткости до 10 мг-экв/л с глубиной умягчения воды до 0,01-0,02 мг-экв/л, не достигаемый другими способами.
Выбор того или иного способа умягчения воды проводят путем техникоэкономического сравнения различных методов с учетом местных условий и требований, предъявляемых к умягченной воде со стороны потребителя.
Также для снижения жесткости воды, т.е. для ее умягчения могут применяться методы:
-электродиализа, который основан на явлении направленного движения ионов электролита к электродам, подключенным к сети постоянного тока. Таким образом, ионы металлов, обуславливающие жесткость воды, задерживаются у электродов и отделяются от воды, выходящей из аппарата водоочистки.
-магнитная обработка воды заключается в пропускании воды через систему магнитных полей противоположной направленности. В результате этого происходит уменьшение степени гидратации растворенных веществ и их объединение в более крупные частицы, которые выпадают в осадок.
-ультразвуковая обработка воды также приводит к образованию более крупных частиц растворенных веществ с образованием осадка.

12
1.2 Лабораторная работа №1 Умягчение воды термическим методом
Цель работы: установить степень умягчения данной воды термическим способом при различной продолжительности нагрева воды.
Методика выполнения работы
Висследуемой воде определяются жесткость общая, жесткость карбонатная, концентрация катионов Са2+ и Mg2+, щелочность, величина рН, содержание углекислоты. Вода разливается в 3 колбы емкостью 1 л, которые ставятся на электроплитки для ее кипячения. С целью сокращения процесса упаривания колбы покрываются пробками с вставленными в них обратными холодильниками, стеклянными трубками, или покрываются воронками.
Водной колбе вода кипятится в течение 15 мин, во второй - 30 мин, в третьей - 1 ч. Время замечают от начала закипания. После кипячения вода в колбах охлаждается, фильтруется через бумажный фильтр «синяя лента» и анализируется. В фильтрате определяются те же показатели, что и в исходной воде. Результаты анализов заносят в табл. 1.
По результатам исследований делается вывод о глубине умягчения данной воды термическим методом.
Эффект умягчения определяется по формуле:
|
|
|
Эум = ((Жисх – |
Жум) / Жисх) · 100, % |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Таблица 1. |
||
|
|
|
Результаты исследований |
|
|
|
|||||||
|
Время |
|
|
|
Качественные показатели воды |
|
|
Эффект |
|||||
|
Жесткость, мг-экв/л |
2+ |
2+ |
Щелочность |
|
|
|||||||
|
кипячения, |
|
|
умягчения, |
|||||||||
Наименование |
|
|
|
|
Са , |
Mg , |
общая, |
рН |
СО2, |
||||
общая |
карб. |
некарб. |
|||||||||||
|
мин |
мг/л |
мг/л |
мг-экв/л |
|
мг/л |
% |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вода исходная |
|
|
|
|
|
|
|
|
|
|
|
|
|
Вода после |
15 |
|
|
|
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
|
|
|
|
||
кипячения |
|
|
|
|
|
|
|
|
|
|
|
||
60 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
1.3 Лабораторная работа №2 Умягчение воды катионитовым способом на ионообменном
фильтре в Н-форме
Цель работы: установить степень умягчения данной воды катионитовым способом при фильтровании воды через фильтр в Н-форме.
Методика выполнения работы Исследования проводят на моделях фильтров (см. рис. 1) с загрузкой
катионита (сульфоуголь, КУ-2-8, Леватит или др. (см. прилож.1)).
Питание фильтра исходной водой осуществляется из рабочего сосуда (бутыли), расположенного на высоте около 0,5 м над уровнем жидкости в фильтре, что обеспечивает самотечное поступление воды для фильтрации. Из рабочей емкости исходная вода подается по шлангу с винтовым зажимом.

13
4
1 

 2
2
5
3
Рисунок 1. - Лабораторная установка с ионообменными фильтрами Условные обозначения:
1 - Н-катионитовый фильтр первой ступени, 2 - Na-катионитовый фильтр второй ступени, 3 - емкость для сбора фильтрата, 4 - емкость исследуемой воды, 5 – винтовой зажим
Для проведения работы необходимо иметь фильтр с загрузкой отрегенерированной по форме Н[К] (раствором НCI). Нижняя часть модели фильтра заканчивается конусом с сливным штуцером, на который надевается резиновый шланг с винтовым зажимом, с помощью которого регулируется скорость фильтрации.
В исследуемой воде определяются следующие ее показатели: жесткость
общая, количество катионов Cа2+ и Mg2+, щелочность, кислотность, величина рН, содержание углекислоты.
На модели фильтра устанавливается расчетная средняя линейная скорость фильтрования 5 м/ч. Для этого необходимо рассчитать объемную скорость фильтрования для данного живого сечения колонки по формуле:
Q = S · V, мл/мин,
где Q – объемная скорость фильтрования, мл/мин (см3/мин);
S – площадь живого сечения колонки, см2;
V – линейная скорость фильтрования, см/мин.
Исследуемая вода фильтруется со скоростью 5 м/ч через загрузку модели фильтра с катионитом в Н-форме. Первые порции фильтрата сбрасываются (два объема загрузки), последующие отбираются для анализа. В фильтрате определяют те же показатели, что и в исходной воде. Результаты анализов заносят в табл. 2.
Результаты анализов заносят в табл. 2.
По результатам исследований делается вывод о степени умягчения исследуемой воды и возможности применения ее для определенных нужд.
14
|
|
|
|
|
|
|
|
|
|
Таблица 2. |
|
|
|
|
Результаты исследований |
|
|
|
|||||
|
|
|
|
Качественные показатели воды |
|
|
|
|
|||
Наименование |
Жесткость |
Са2+, |
|
Mg2+, |
Щелочность |
рН |
|
Кислотность, |
СО2, |
|
Эффект |
|
общая, |
мг/л |
|
мг/л |
общая, |
|
мг-экв/л |
мг/л |
|
умягчения, % |
|
|
мг-экв/л |
|
мг-экв/л |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Вода исходная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вода после |
|
|
|
|
|
|
|
|
|
|
|
Н[K] |
|
|
|
|
|
|
|
|
|
|
|
1.4 Лабораторная работа №3 Определение обменной емкости катионита
Цель работы: определить обменную емкость Nа-катионита данной марки в динамических условиях.
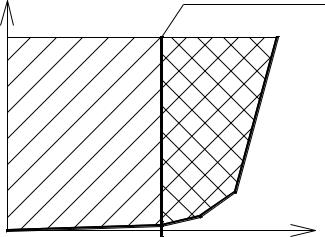
Основной технологической характеристикой ионитов является их обменная ёмкость, которая определяется количеством миллиграммэквивалентов ионов, извлеченных из воды 1 г воздушно-сухого ионита. В практике водообработки обменную емкость ионитов выражают количеством грамм-эквивалентов ионов, поглощенных 1 мЗ ионита в набухшем, т.е. рабочем состоянии. Различают полную и рабочую обменную емкость катионита (рис. 2).
Полной обменной емкостью называют то количество катионов жесткости, которое может задержать 1 м3 катионита, находящегося в рабочем состоянии, до того момента, когда жесткость фильтрата сравняется с жесткостью исходной воды.
Рабочей обменной емкостью катионита называют количество катионов жесткости, которое может задержать 1 м3 катионита до момента «проскока» в фильтрат катионов жесткости.
3 |
проскок жесткости |
|
м |
||
/ |
в фильтрат |
|
, г-экв |
||
|
||
Жесткость |
Б |
|
А |
||
|
||
|
Объем фильтрата, м3 |
Условные обозначения:
А - рабочая обменная емкость А+Б - полная обменная емкость
Рисунок 2. - Обменная емкость ионитов
15
В качестве примера статическая обменная емкость катионита КУ- 2 по ионам: Са2+, определенная по 0,1 н. раствору CaCI2, составляет 4,3- 4,9 г-экв/л.
Методика выполнения работы
1.Навеску набухшего катионита КУ-2 (или другой марки) в Nа-форме массой 20 г (в пересчете на воздушно-сухое вещество) помещают в стеклянную колонку (см. рис. 1 л.р. №2).
2.Рассчитывают объемную скорость фильтрования для данного живого сечения колонки и линейной скорости фильтрования 5 м/ч (см. расчет л.р. №2).
3.Рассчитывают необходимое количество сухого CaC12 для приготовления 2 литров 0,1 н. раствора.
Для справки:
Единица нормальности раствора – это число г-эквивалентов вещества, растворенного в 1 литре раствора. (1 н.р. = г-экв в-ва / 1 литр).
Эквивалент – это эквивалентная молярная масса вещества. Формула нахождения эквивалентной массы вещества зависит от того, к какому классу относиться исследуемое соединение. (Пр. для солей Э = молярная масса / (число атом металла · валентность металла)).
4.Готовят примерно 0,1 н. раствор CaC12, определяют его фактическую жесткость.
5.Полученный раствор фильтруют через катионит со скоростью 5 м/ч. Отбирают пробы фильтрата по 100 мл. В каждой пробе определяют жесткость. Необходимо определить момент - начала «проскока» катионов жесткости. Фильтрование проводят до тех пор, пока концентрация ионов жесткости в фильтрате не достигнет концентрации в исходной воде.
6.Данные всех опытов заносят в табл. 3.
|
|
|
Таблица 3. |
|
Результаты исследований |
|
|
Номер пробы |
Объем фильтрата, л |
Жесткость общая, мг-экв/л |
Примечание |
Исходная вода |
- |
|
|
1 |
|
|
|
……. |
|
|
|
7.По результатам опыта строят график зависимости остаточной жесткости фильтрата от объема профильтрованной воды. На графике отмечают полную и рабочую обменную емкость данного катионита.
8.По полученным данным рассчитывают рабочую обменную емкость катионита Е р(сух) на 1 г воздушно-сухого катионита:
Е р(сух) = (Vпр · Жисх) / m, мг-экв/г,
где Жисх - исходная жесткость исследуемой воды, мг-экв/л (г-экв/м3); Vnp - объем фильтрата до начала «проскока» катионов жесткости, л;
m- навеска катионита в пересчете на воздушно-сухое вещество, гр.
9.Рассчитывают рабочую обменную емкость Ep(набух) на 1 м3 загрузки в набухшем состоянии:

16
Е р(набух) = (Vпр · Жисх) / Vкат, г-экв/м3
где Жисх - исходная жесткость исследуемой воды, мг-экв/л (г-экв/м3);
Vnp - объем фильтрата до начала «проскока» катионов жесткости, мл
(см3);
Vкат - объем катионита в набухшем состоянии, см3.
1.5. Лабораторная работа №4 Умягчение воды способом последовательного
H-Na катионирования
Цель работы: установить степень умягчения данной воды способом последовательного Н-Na катионирования.
Методика выполнения работы Исследования проводят на моделях фильтров (см. рис. 1) описанных в
лабораторной работе №2.
Для проведения работы необходимо иметь два фильтра: загрузка одного отрегенерирована по форме Na[К] (раствором NaCI), загрузка другого - по форме Н[К] (раствором HCl или H2SО4).
В исследуемой воде определяются следующие ее показатели: жесткость
общая, количество катионов Cа2+ и Mg2+, щелочность, кислотность, величина рН, содержание углекислоты.
На моделях фильтров один и два устанавливается расчетная средняя линейная скорость фильтрования 5 м/ч (расчет см. лабораторную работу №2).
Сначала исследуемая вода фильтруется со скоростью 5 м/ч через загрузку модели фильтра с катионитом в Н-форме. Первые порции фильтрата сбрасываются (два объема загрузки), последующие отбираются для анализа и дальнейшего фильтрования. В фильтрате после Н[K] фильтра определяют те же показатели, что и в исходной воде.
Далее собранная вода после H[K] фильтра фильтруется со скоростью 5 м/ч через загрузку модели фильтра с катионитом в Na[К] форме. В фильтрате после Na[K] фильтра определяют те же показатели, что и в исходной воде.
Результаты анализов заносят в табл. 3.
По результатам исследований делается вывод о степени умягчения исследуемой воды и возможности применения данного способа умягчения для исследуемой воды.
|
|
|
|
|
|
|
|
|
Таблица 3. |
|
|
|
|
Результаты исследований |
|
|
|
||||
|
|
|
Качественные показатели воды |
|
|
|
|
|||
Наименование |
Жесткость |
Са2+, |
Mg2+, |
Щелочность |
рН |
|
Кислотность, |
СО2, |
|
Эффект |
|
общая, |
мг/л |
мг/л |
общая, |
|
мг-экв/л |
мг/л |
|
умягчения, % |
|
|
мг-экв/л |
мг-экв/л |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Вода исходная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вода после |
|
|
|
|
|
|
|
|
|
|
Н[K] |
|
|
|
|
|
|
|
|
|
|
Вода после |
|
|
|
|
|
|
|
|
|
|
Na[K] |
|
|
|
|
|
|
|
|
|
|

17
РАЗДЕЛ 2.
ИССЛЕДОВАНИЕ МЕТОДОВ ОБЕССОЛИВАНИЯ ВОДЫ
2.1 Общая часть
Целый ряд различных стран мира, а также районов России ощущают острый дефицит в пресной воде. Поэтому часто возникает необходимость в использовании для целей водоснабжения источников соленых и солоноватых вод при соответствующей их обработке, позволяющей снижать содержание растворенных в них солей.
Процесс удаления солей из воды в зависимости от степени их извлечения называют обессоливанием или опреснением.
Обессоливание воды – это процесс снижения концентрации растворенных солей до предела, близкого к содержанию их в дистиллированной воде, до 5 мг/л и ниже.
Опреснение - процесс снижения содержания солей в воде (общего солесодержания) до норм, указанных СанПиН 2.1.4.1074-01 [1], т.е. до 1000 мг/л, т.е. до концентрации, допустимой при использовании воды для хозяйственно-питьевых нужд.
Опреснение используется для получения воды питьевого качества, а обессоливание применяется для получения чистой и ультрачистой воды для фармацевтики, медицины, микроэлектроники, теплоэнергетической, химической и других отраслей промышленности.
В настоящее время известно большое количество способов выделения солей из природных вод. В зависимости от физико-химических особенностей протекающих процессов все методы обессоливания можно разделить на две большие группы: методы, идущие с изменением агрегатного состояния воды; методы, идущие без изменения агрегатного состояния воды.
К первым методам относятся обессоливание и опреснение воды дистилляцией, замораживанием, кристаллогидрацией, гелиоопреснением. Ко вторым - химические и электрохимические способы, гиперфильтрация, экстракция, элекродиализ, обратный осмос и т.д. Выбор метода для каждого конкретного случая должен определяться на основании целесообразности и технико-экономических расчетов.
Самым распространенным способом опреснения, особенно морских вод, является метод дистилляции. Это объясняется простотой конструктивного решения, достаточно высокой эффективностью. Сущность этого метода состоит в том, что соленую воду нагревают до температуры, превышающей температуру её кипения. В этих условиях молекулы воды за счет теплового и колебательного движений приобретают энергию, достаточную для преодоления сил межмолекулярного притяжения, и выносятся в паровое пространство. Ионы растворенных солей при этом не имеют такого запаса энергии, остаются в растворе. Образующийся пар конденсируется и образует пресную воду. Опреснение воды дистилляцией может производиться при повышенном и атмосферном давлении, под вакуумом и с применением термокомпрессии.

18
При применении данного метода следует иметь в виду, что при высоком солесодержании исходной воды может потребоваться ее умягчение или
частичное обессоливание для снижения накипеобразования.
|
Опреснение или |
обессоливание |
воды химическим методом |
|||
(ионного |
обмена) |
основано |
на |
последовательном |
пропускании |
|
ее через группы фильтров, загруженных катионо- и анионообменными зернистыми материалами. Процессы опреснения или обессоливания протекают в две ступени: удаления из воды катионов (катионирование) и удаления анионов (анионирование). Катионирование происходит при фильтрации опресняемой воды через слой катионита, способного в определенных условиях вступать в обменную реакцию с катионами раствора. При этом катионы, находящиеся в исходной воде, в эквивалентном количестве обмениваются на катионы, которыми катионит был предварительно заряжен. При опреснении и обессоливании используют катиониты, заряженные обменным катионом водорода. При прохождении соленой воды через катионит протекают следующие реакции обмена:
2[K]H + Ca(HCO3)2 |
|
[K]2Ca + 2CO2 + 2H2O |
2[K]H + Mg(HCO3)2 |
[K]2Mg + 2CO2 + 2H2O |
|
2[K]H + CaCl2 |
[K]2Ca + 2HCl |
|
2[K]H + MgCl2 |
|
[K]2Mg + 2HCl |
2[K]H + CaSO4 2[K]H + MgSO4 2[K]H + Na2 SO4
[K]2Ca + H2SO4
 [K]2Mg + H2SO4
[K]2Mg + H2SO4
 2[K]Na + H2SO4
2[K]Na + H2SO4
где [К] - сложный комплекс катионита.
В результате обменных процессов растворенные в воде соли превращаются в соответствующие кислоты.
Для анионирования воду фильтруют через загрузочный материал - анионит, способный вступать в обменные реакции с анионами раствора с заменой их эквивалентным количеством анионов, которыми анионит был предварительно заряжен. При этом протекают следующие реакции:
[AH]OH + HCl  [AH]Cl + H2О
[AH]Cl + H2О
2[АН]OH + H2SО4  [AH]2SО4 + 2H2О
[AH]2SО4 + 2H2О
где [АН] - сложный неподвижный комплекс анионита.
При работе ионитов происходит их истощение, что приводит к проскоку в фильтрат растворенных солей воды. Для восстановления ионообменной способности иониты подвергают регенерации.
Регенерацию катионита проводят раствором кислоты, обычно серной, концентрацией 1-1,5%. Реакции регенерации катионита:

19
[K]2Ca + H2SО4  2[K]Н + CaSO4
2[K]Н + CaSO4
[K]2Mg + H2SO4  2[K]H + MgSO4 2[K]Na + H2SO4
2[K]H + MgSO4 2[K]Na + H2SO4  2[K]H + Na2 SO4
2[K]H + Na2 SO4
Истощенный в процессе обмена анионит регенерируется растворами щелочей:
[AH]CI + NaOH  [AH]OH + NaCl
[AH]OH + NaCl
[AH]2SO4 + NаОН  [АН]OH + Na2SO4
[АН]OH + Na2SO4
2[АН]Сl + Nа2СО3  [AH]2CO3 + 2NaCl
[AH]2CO3 + 2NaCl
[AH]2SO4+N а2СО3  [АН]2СО3 + Na2SО4
[АН]2СО3 + Na2SО4
Успешно проведенная регенерация полностью восстанавливает обменную способность ионита. При обессоливании воды используются как сильнокислотные, так и слабокислотные катиониты. Первые способны к обмену при любых значениях рН воды, вторые взаимодействуют только при рН воды более 7. Для опреснения соленых вод применяют искусственные как отечественные катиониты (сульфоуголь, KУ-l; КУ-2-8; КБ-4П-2 и др.), так и зарубежные.
Аниониты, используемые в опреснительных установках, подразделяют на сильноосновные и слабоосновные. Первые способны к обмену в кислой и щелочной средах, слабоосновные - только в кислой среде при рН воды меньше 7. Слабоосновные аниониты обменивают с опресняемой водой только анионы сильных кислот. Сильноосновные аниониты способны к поглощению слабых кислот, при этом они должны быть отрегенерированы только раствором щелочи NaOH. Они значительно дороже слабоосновных анионитов и поэтому используются главным образом для удаления из воды слабой кремниевой кислоты.
В опреснительных и обессоливающих установках могут использоваться как отечественные аниониты (АН, АВ-17), так и зарубежные (см. прилож. 2). Аниониты при длительной работе окисляются кислородом воды, а поглощение органических веществ приводит к образованию на поверхности зерен необратимых пленок продуктов поглощения. В результате этого уменьшается обменная способность анионитов. Поэтому при обработке природных вод со значительной концентрацией органических веществ в них перед поступлением на ионитовые фильтры вода проходит фильтры, загруженные активированным углем.
Применение ионного обмена предпочтительно для воды с солесодержанием менее 1000 мг/л, т. к. с увеличением солесодержания воды снижается глубина обессоливания или опреснения и резко возрастает стоимость обработки воды. Для воды с солесодержанием свыше 1000 мг/л выбор метода обессоливания должен производиться на основании экономического сравнения ионитового и испарительного методов.
При ионном обмене обессоливание воды может быть достигнуто частичное, глубокое и полное. Частичное обессоливание воды используется,

20
когда необходимо удалить из воды полностью соли жесткости и по возможности анионы сильных кислот.
Частным случаем частичного обессоливания воды является ее опреснение, т. е. получение воды с солесодержанием до 1000 мг/л.
Глубокое обессоливание воды проводят, когда необходимо удалить из воды все катионы и анионы сильных кислот.
Полное обессоливание используется, когда необходимо полностью удалить из воды растворенные катионы и анионы, включая слабую кремниевую кислоту.
2.2. Лабораторная работа №5 Обессоливание воды методом ионного обмена
Цель работы: провести обессоливание воды по одной из предложенных схем методом ионного обмена. Определить степень обессоливания или опреснения воды.
Методика выполнения работы Работа по опреснению и обессоливанию воды проводится на лабораторной
установке (рис. 3), которая состоит из шести моделей фильтров, изготовленных из органического стекла. Над фильтрами находится полка, на которую устанавливают бутыль с водой, подлежащей фильтрации. Под фильтрами ставятся приемные емкости для фильтрата. Скорость фильтрации регулируется винтовыми зажимами, которые надеты на резиновые шланги от нижних патрубков фильтров.
Путем последовательного фильтрования обрабатываемой воды через определенный набор фильтров установка позволяет проводить или частичное, или глубокое, или полное химическое обессоливание воды, т.е. по трем технологическим схемам.
Схема 1. Частичное химическое обессоливание:
Угольный фильтр (поз. 1) – [ К]Н-фильтр (поз. 2) – Анионитовый слабоосновный фильтр (поз.4) – Декарбонизация - [К]Na-фильтр (поз. 3)
Схема 2. Глубокое химическое обессоливание:
Угольный фильтр (поз. 1) – [ К]Н-фильтр первой ступени (поз. 2) – [ К]Н- фильтр второй ступени (поз. 6) – Анионитовый слабоосновный фильтр (поз.4) –
Декарбонизация
Схема 3. Полное химическое обессоливание:
Угольный фильтр (поз. 1) – [ К]Н-фильтр первой ступени (поз. 2) – Анионитовый слабоосновный фильтр (поз.4) – [ К]Н-фильтр второй ступени (поз. 6) – Декарбонизация – Анионитовый сильноосновный фильтр (поз.5)
