
1220
.pdf№ |
|
Что добавлено |
Изменения |
Направление |
пробирки |
|
|
интенсивности окраски |
смещения равновесия |
|
|
|
|
|
1 |
|
Н2О |
|
|
|
|
|
|
|
2 |
|
FeCl3 |
|
|
|
|
|
|
|
3 |
|
NH4CNS |
|
|
|
|
|
|
|
4 |
|
NH4Cl |
|
|
|
|
|
|
|
Вывод: …( |
сделать самостоятельно, отразив соответствие полученных |
|||
экспериментальных результатов поставленной цели работы).
Лабораторная работа №2
Смещение химического равновесия при изменении температуры.
Цель работы: исследовать смещение химического равновесия для реакции, протекающей в газовой фазе.
Обратимая химическая реакция димеризации оксида азота в газовой фазе сопровождается значительным изменением окраски.
2 NO2(г) (бурый) N2O4(г) (бесцветный)
Константа равновесия данной реакции имеет вид:
Кс = Кр =
(константу равновесия для данной реакции через равновесные концентрации и равновесные парциальные давления записать самостоятельно)
Так как данная реакция имеет дольно существенный тепловой эффект. То изменение температуры приводит к заметному изменению цвета газовой смеси.
Экспериментальная часть
1.Взять стеклянный прибор, заполненный смесью NO2 и N2O4, находящийся в состоянии химического равновесия при комнатной температуре. Отметить одинаковую интенсивность окраски в обеих частях прибора.
2.Поставить рядом два химических стакана: один – с горячей, другой – с холодной водой.
3.Одновременно опустить прибор в оба стакана, наблюдать изменение окраски при охлаждении и нагревании смеси NO2 и N2O4. Занести опытные данные в таблицу.
Условия опыта |
Окраска газа в сосудах |
Концентрация NO2 |
|
|
|
Т комнатная |
одинаковая |
исходная |
|
|
|
Охлаждение |
|
|
|
|
|
Нагревание |
|
|
|
|
|
Вывод: . . . (на основании данных табл.2 и принципа Ле-Шателье сделайте вывод о знаке теплового эффекта прямой и обратной реакции).

Тестовые задания
Вариант 1.
1. В какой реакции увеличение объема системы не вызовет смещения равновесия
1) 2 SO2 (г) + О2 (г) 2 SO3 (г) |
3) PCl5 (г) |
PCl3 (г) + Cl2 (г) |
||
2) N2O4 (г) |
2 NO2 (г) |
4) Н2 (г) + I2 (г) |
2 НI(г) |
|
2. Равновесие в системе 2 SO2(г) |
+ O2(г) |
2 SO3(г) смещается в сторону |
||
прямой реакции если: |
|
|
|
|
1)увеличить давление и увеличить температуру
2)увеличить давление и уменьшить температуру
3)уменьшить давление и уменьшить температуру
4)уменьшить давление и увеличить температуру
3. Для гомогенной обратимой реакции |
2 SO3(г) |
2 SO2(г) + O2(г) |
|
|
запишите константу равновесия. |
|
|
|
|
4. При уменьшении концентрации О2 (г) в реакции |
2СО(г) + О2 (г) |
2 СО2(г) |
||
равновесие |
|
|
|
|
1) сместится → |
3) не сместится |
|
|
|
2)сместится ← 4) нельзя определить
5.Как повлияет на равновесие следующих реакций:
1) 2Н2 (г) + О2 (г) |
2Н2О(г) ΔН = -483,6 кДж |
2) СаСО3(кр) |
СО2 (г) + СаО(кр) Н = 179 кДж |
повышение температуры?

Вариант 2.
1. Запишите выражение для констант равновесия следующих реакций (Кр):
1) Р4(тв) + 3О2(г) 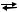 Р4О6(г) 2) NO2(г) + O2 (г)
Р4О6(г) 2) NO2(г) + O2 (г)  NO(г) + О3(г)
NO(г) + О3(г)
2.Для реакции 2 NO(г) + О2 (г) 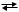 2 NO2(г) при повышении концентрации NO равновесие:
2 NO2(г) при повышении концентрации NO равновесие:
1) сместится → |
3) не сместится |
2)сместится ← 4) нельзя определить
3.При повышении давления равновесие в системе
N2 (г) + + I2 (г) |
2 NI (г) |
|
1) сместится → |
3) не сместится |
|
2)сместится ← 4) нельзя определить
4.Реакция, в которой повышение давления и повышение температуры вызовет смещение равновесие в одну сторону, - это
1) |
2NO(г)+O2(г) |
2NO2(г) |
H<0 |
|
|
2) |
2CuO(т) + СО2 (г) + 2Н2О(г) |
Cu2CO3(OH)2(т) |
H<0 |
|
|
3) 6HF(г) + N2(г) |
2NF3(г) + 3H2(г) H>0 |
|
|
||
4) MgO(т) + СО2 (г) |
MgCO3(т) |
H<0 |
|
|
|
5. Равновесие реакции 4FeS2(т) + 11O2(г) |
8SO2(г) + 2Fe2O3(т) |
H<0 |
|||
сместится вправо при: |
|
|
|
|
|
а) повышение концентрации SO2 ; |
б) дополнительном введение Fe2O3 |
||||
в) понижение температуры; |
г) дополнительном введение FeS2 |
||||
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1.Глинка Н.Л. Общая химия: учеб. пособие для нехим. специальностей вузов. - М.: Интеграл-Пресс, 2008. - 704 с.
2.Зайцев О.С. Общая химия. Состояние веществ и химические реакции. -
М.: Химия, 1990. - 352 с.
3.Зайцев О.С. Общая химия. Направление и скорость химических процессов. Строение вещества. - М.: Высшая школа, 1983. - 248 с.
4.Глинка Н.Л. Задачи и упражнения по общей химии: учеб. пособие для нехим. специальностей вузов. - М.: Интеграл-Пресс, 2001. - 264 с.
5.Ахметов Н.С. Общая и неорганическая химия. - М.: Высшая школа, 1982. – 320 с.

Светлана Валерьевна Митрофанова
Ирина Леонидовна Смельцова
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Учебно-методическое пособие
Методические указания по выполнению лабораторных работ по дисциплине «Химия»
для обучающихся по направлению подготовки 09.03.02 Информационные системы и технологии
Федеральное государственное бюджетное образовательное учреждение высшего образования «Нижегородский государственный архитектурно-строительный университет»
603950, Нижний Новгород, ул. Ильинская, 65.
http://www. nngasu.ru, srec@nngasu.ru
